解题方法
1 . 近期,美国航天局(NASA)通过韦伯太空望远镜发现在一颗巨大系外行星(K2-18b)的大气层中存在生命迹象气体——二甲硫醚(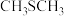 )。已知:二甲硫醚的沸点为38℃,熔点为-98℃。下列有关叙述正确的是
)。已知:二甲硫醚的沸点为38℃,熔点为-98℃。下列有关叙述正确的是
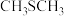 )。已知:二甲硫醚的沸点为38℃,熔点为-98℃。下列有关叙述正确的是
)。已知:二甲硫醚的沸点为38℃,熔点为-98℃。下列有关叙述正确的是A.标准状况下,11.2L二甲硫醚中含4mol 键 键 |
| B.二甲硫醚分子中电负性最小的元素是硫元素 |
C.6.2g二甲硫醚分子中含 杂化的原子数为 杂化的原子数为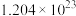 |
| D.乙二醇与二甲硫醚的相对分子质量相等但乙二醇的沸点高于38℃ |
您最近半年使用:0次
2 . 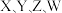 四种短周期元素,
四种短周期元素, 的一种核素没有中子,其余三种在周期表中位置如图所示,下列判断正确的是
的一种核素没有中子,其余三种在周期表中位置如图所示,下列判断正确的是
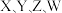 四种短周期元素,
四种短周期元素, 的一种核素没有中子,其余三种在周期表中位置如图所示,下列判断正确的是
的一种核素没有中子,其余三种在周期表中位置如图所示,下列判断正确的是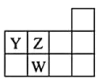
A.单质 与 与 常温下能直接化合 常温下能直接化合 | B.简单氢化物的沸点: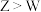 |
C.电负性: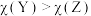 | D. 三种元素组成的化合物是离子化合物 三种元素组成的化合物是离子化合物 |
您最近半年使用:0次
名校
解题方法
3 . 下列说法中,正确的是
| A.N、P、S的第一电离能依次减小 | B.Li、Na、K的电负性依次增大 |
| C.F、O、Na的原子半径依次减小 | D.甲烷、氨气、水的键角依次增大 |
您最近半年使用:0次
解题方法
4 . 氧和硫是元素周期表中第ⅥA族元素。下列说法正确的是
| A.电负性:O<S | B.沸点: |
C. 是极性分子 是极性分子 | D. 空间构型为平面三角形 空间构型为平面三角形 |
您最近半年使用:0次
2024-04-07更新
|
213次组卷
|
2卷引用:海南省海口市2024届高三上学期摸底考试化学试卷
5 . 按要求回答下列问题:
(1)下列B原子的电子排布式的状态中,能量最高的是________(用字母表示)。
(2)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛,回答下列问题:
①基态Ge原子的简化的电子排布式为________ ,基态原子核外有________ 种空间运动状态。
②比较下列锗卤化物的熔点和沸点,分析呈现该变化规律的原因是________________________________ 。
③光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子 的空间构型为
的空间构型为________ ,Na在空气中燃烧则发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为________ 光谱(填“发射”或“吸收”)。
(4)元素镍与镍钴合金的晶胞结构分别如图a、b所示:
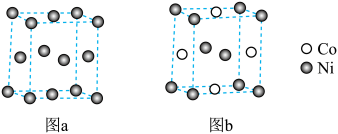
①镍钴合金若写作NixCo1-x,则图b合金中x=________
②已知晶胞(图a)的边长为m pm,设NA为阿伏加德罗常数的值,则镍的密度为________ g/cm3(列出计算式)。
(1)下列B原子的电子排布式的状态中,能量最高的是________(用字母表示)。
A. | B.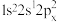 | C. | D.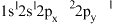 |
(2)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛,回答下列问题:
①基态Ge原子的简化的电子排布式为
②比较下列锗卤化物的熔点和沸点,分析呈现该变化规律的原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子
 的空间构型为
的空间构型为(4)元素镍与镍钴合金的晶胞结构分别如图a、b所示:

①镍钴合金若写作NixCo1-x,则图b合金中x=
②已知晶胞(图a)的边长为m pm,设NA为阿伏加德罗常数的值,则镍的密度为
您最近半年使用:0次
6 . 物质结构决定性质。下列有关物质性质的解释错误的是
选项 | 物质性质 | 解释 |
A | 一氟乙酸的 |
|
B |
| 三者均为非极性分子 |
C | 对羟基苯甲酸的沸点高于邻羟基苯甲酸 | 对羟基苯甲酸分子间存在氢键 |
D | 乙烯比乙炔活泼 | 分子间范德华力:乙烯>乙炔 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7 . 第ⅣA族元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态锗原子的价层电子轨道表示式为______ ,第ⅣA族元素位于______ 区。
(2) 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是_________________ 。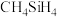 、
、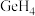 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是______________________ 。
(3) 的VSEPR模型名称为
的VSEPR模型名称为________________________________ 。
(4)碳化硅( )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为______ 。
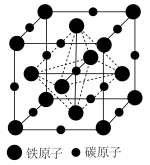
(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为______ ,铁晶体转化为铁碳晶体时晶体密度净增______ %(结果保留3位有效数字)。
(1)基态锗原子的价层电子轨道表示式为
(2)
 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是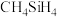 、
、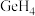 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是(3)
 的VSEPR模型名称为
的VSEPR模型名称为(4)碳化硅(
 )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为
您最近半年使用:0次
名校
8 . 下表为元素周期表前三周期的一部分:
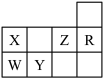
(1)Y的基态原子的电子排布式为___________ 。
(2)X的氢化物的沸点与W的氢化物的沸点比较:________ >_______ (填化学式),原因是________ 。
(3)选出X的基态原子的电子排布图___________ ,另一电子排布图不能作为基态原子的电子排布图是因为它不符合___________ (填序号)。

A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,___________ (填元素符号)元素第一电离能最大,___________ 元素的电负性最大。
(5)由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如下图所示,则下列判断错误的是___________ 。
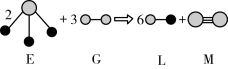
A.G是最活泼的非金属单质
B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键

(1)Y的基态原子的电子排布式为
(2)X的氢化物的沸点与W的氢化物的沸点比较:
(3)选出X的基态原子的电子排布图

A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,
(5)由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如下图所示,则下列判断错误的是

A.G是最活泼的非金属单质
B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键
您最近半年使用:0次
名校
解题方法
9 . 下列实验操作、现象与结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向盛有2mL0.5mol/LNaOH溶液中先滴加2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先出现白色沉淀,后沉淀变为红褐色 | 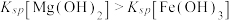 |
| B | 向盛有少量Mg(OH)2沉淀的试管中加入适量饱和CH3COONH4溶液,振荡 | 白色沉淀溶解 |  结合了OH-,促使Mg(OH)2溶解平衡正移 结合了OH-,促使Mg(OH)2溶解平衡正移 |
| C | 用玻璃棒蘸取NaHCO3溶液点在pH试纸上 | 试纸变红 |  的电离程度大于水解程度 的电离程度大于水解程度 |
| D | 比较电负性:室温下,用pH计测定0.1mol·L-1的CF3COOH、CCl3COOH两种溶液的pH | CF3COOH溶液的pH较小 | F元素的电负性大于Cl元素 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、 等元素。回答下列问题:
等元素。回答下列问题:
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是_______。
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,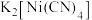 是红黄色单斜晶体。
是红黄色单斜晶体。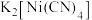 的熔点高于
的熔点高于 的原因是
的原因是______ 。
(3)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用 表示),它与中心离子的结构、电荷、配体有关。试判断分裂能
表示),它与中心离子的结构、电荷、配体有关。试判断分裂能
______  (填“>”“<”或“=”),理由
(填“>”“<”或“=”),理由_______ 。
(4) 中的元素的电负性由大到小的顺序为
中的元素的电负性由大到小的顺序为_____ (用元素符号回答); 中
中 与
与 之间形成的化学键为
之间形成的化学键为_______ 。
(5)一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中。已知
填充其中。已知 的半径为
的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则每平方米上分散的该晶体的质量为
,则每平方米上分散的该晶体的质量为______ g。(写出表达式即可。下图中大白球表示 ,小黑球表示
,小黑球表示 )
)

 等元素。回答下列问题:
等元素。回答下列问题:(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是_______。
A. | B.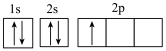 |
C. | D.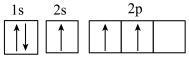 |
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,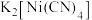 是红黄色单斜晶体。
是红黄色单斜晶体。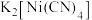 的熔点高于
的熔点高于 的原因是
的原因是(3)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用
 表示),它与中心离子的结构、电荷、配体有关。试判断分裂能
表示),它与中心离子的结构、电荷、配体有关。试判断分裂能
 (填“>”“<”或“=”),理由
(填“>”“<”或“=”),理由(4)
 中的元素的电负性由大到小的顺序为
中的元素的电负性由大到小的顺序为 中
中 与
与 之间形成的化学键为
之间形成的化学键为(5)一定温度下,
 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中。已知
填充其中。已知 的半径为
的半径为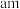 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则每平方米上分散的该晶体的质量为
,则每平方米上分散的该晶体的质量为 ,小黑球表示
,小黑球表示 )
)
您最近半年使用:0次
2024-02-14更新
|
98次组卷
|
2卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题

 大于一溴乙酸
大于一溴乙酸 的电负性比
的电负性比 的大
的大 、
、 易溶于
易溶于


