解题方法
1 . 近日,大连化物所利用Na-S协同改性铁催化剂,实现了CO2催化加氢合成乙醇。
(1)基态硫原子的价电子排布式为___________ ;基态硫原子核外电子占据的最高能级的电子云轮廓图为___________ 形。
(2)乙醇分子中所涉元素的电负性从大到小的顺序为___________ (用元素符号表示)。
(3)在CO2转化为乙醇的过程中,碳原子的杂化类型由___________ 转化为___________ 。
(4)Na2S的熔点为950℃,K2S的熔点为840℃,前者熔点较高的原因是___________ 。
(5)铁的三种同素异形体晶体的晶胞结构如图所示,三种晶体在不同温度下能发生转化。
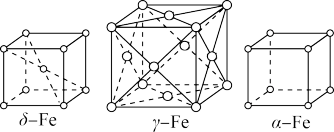
①δ-Fe晶胞与γ-Fe晶胞中含有的铁原子数之比为___________ ,α-Fe晶胞中与铁原子等距离且最近的铁原子数为___________ 。
②假设α-Fe晶胞的体积为a cm3,NA代表阿伏加德罗常数的值,则该α-Fe晶体的密度为___________ g/cm3 (用含a、NA的代数式表示)。
(1)基态硫原子的价电子排布式为
(2)乙醇分子中所涉元素的电负性从大到小的顺序为
(3)在CO2转化为乙醇的过程中,碳原子的杂化类型由
(4)Na2S的熔点为950℃,K2S的熔点为840℃,前者熔点较高的原因是
(5)铁的三种同素异形体晶体的晶胞结构如图所示,三种晶体在不同温度下能发生转化。

①δ-Fe晶胞与γ-Fe晶胞中含有的铁原子数之比为
②假设α-Fe晶胞的体积为a cm3,NA代表阿伏加德罗常数的值,则该α-Fe晶体的密度为
您最近一年使用:0次
2 . 铜是人类最早发现并广泛使用的一种金属。黄铜矿是主要的炼铜原料, 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:
(1)铜的价电子排布式为___________ ;
(2)稳定性:
___________  (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因___________ 。
(3) 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序___________ (用元素符号表示)。
(4)在较低温度条件下, 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为___________ ;X分子的立体构型为___________ 。
(5) 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为___________ 。
(6)硫酸铜( )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为___________ 。
 是其中铜的主要存在形式。回答下列问题:
是其中铜的主要存在形式。回答下列问题:(1)铜的价电子排布式为
(2)稳定性:

 (填“<”“=”或“>”);并解释有关原因
(填“<”“=”或“>”);并解释有关原因(3)
 中三种元素的电负性由大到小的顺序
中三种元素的电负性由大到小的顺序(4)在较低温度条件下,
 与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为
与浓硫酸反应时,有少量臭鸡蛋气味的气体X产生。则X的电子式为(5)
 与浓硫酸反应可以得到硫酸铜,有关化学方程式为
与浓硫酸反应可以得到硫酸铜,有关化学方程式为(6)硫酸铜(
 )中阴离子的中心原子的杂化类型为
)中阴离子的中心原子的杂化类型为
您最近一年使用:0次
2021-10-25更新
|
95次组卷
|
2卷引用:海南省华中师范大学琼中附属中学2022届高三第二次月考化学试题
3 . 氯乙酸( )是重要的有机化工原料,实验室中先用
)是重要的有机化工原料,实验室中先用 和浓盐酸制备干燥、纯净的
和浓盐酸制备干燥、纯净的 ,然后将
,然后将 通入冰醋酸中生成氯乙酸。回答下列问题:
通入冰醋酸中生成氯乙酸。回答下列问题:
(1)基态Mn原子的价层电子排布图为___________ ,I 1(Mn) ___________ I 1(K) (填“大于”或“小于”)。
(2)氯乙酸的组成元素电负性由大到小的顺序为___________ ;其分子中碳原子的杂化方式为___________
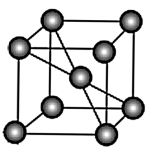
(3) 中两种金属元素单质的晶体结构堆积方式相同,晶胞结构如下图所示。
中两种金属元素单质的晶体结构堆积方式相同,晶胞结构如下图所示。 为阿伏加德罗常数的值。锰的摩尔质量为
为阿伏加德罗常数的值。锰的摩尔质量为 ,晶胞的密度为
,晶胞的密度为 ,则锰的晶胞参数为
,则锰的晶胞参数为___________  (用含
(用含 、
、 、
、 的式子表示)。
的式子表示)。
 )是重要的有机化工原料,实验室中先用
)是重要的有机化工原料,实验室中先用 和浓盐酸制备干燥、纯净的
和浓盐酸制备干燥、纯净的 ,然后将
,然后将 通入冰醋酸中生成氯乙酸。回答下列问题:
通入冰醋酸中生成氯乙酸。回答下列问题:(1)基态Mn原子的价层电子排布图为
(2)氯乙酸的组成元素电负性由大到小的顺序为
(3)
 中两种金属元素单质的晶体结构堆积方式相同,晶胞结构如下图所示。
中两种金属元素单质的晶体结构堆积方式相同,晶胞结构如下图所示。 为阿伏加德罗常数的值。锰的摩尔质量为
为阿伏加德罗常数的值。锰的摩尔质量为 ,晶胞的密度为
,晶胞的密度为 ,则锰的晶胞参数为
,则锰的晶胞参数为 (用含
(用含 、
、 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
解题方法
4 . 铜是应用最广泛的金属之一,其抗氧化防腐技术一直是化学研究的热点课题。
(1)基态铜原子的价电子排布图为_____ ,铜元素位于元素周期表中_____ 区。
(2)我国科学家发现经甲酸钠(HCOONa)溶液热处理后的金属铜具有良好的抗氧化能力。
①组成甲酸钠的四种元素的电负性由大到小的顺序为_____ 。
②HCOO-中碳原子的杂化方式为_____ ,其空间构型为____ 。
③HCOOH能与水任意比互溶的原因为_____ 。
(3)在金属铜表面覆盖WBN型氮化硼(熔点为2967℃)也可以达到金属铜的防腐目的,WBN型氮化硼属于_____ 晶体。
(1)基态铜原子的价电子排布图为
(2)我国科学家发现经甲酸钠(HCOONa)溶液热处理后的金属铜具有良好的抗氧化能力。
①组成甲酸钠的四种元素的电负性由大到小的顺序为
②HCOO-中碳原子的杂化方式为
③HCOOH能与水任意比互溶的原因为
(3)在金属铜表面覆盖WBN型氮化硼(熔点为2967℃)也可以达到金属铜的防腐目的,WBN型氮化硼属于
您最近一年使用:0次
5 . 下列关于N、P及其化合物的结构与性质的叙述错误的是
| A.键能:N-H>P-H,因此NH3的稳定性大于PH3 |
| B.电负性:F>N>H,因此键角NF3>NH3 |
| C.白磷(P4)为正四面体结构,其键角为:60° |
| D.PF5与PCl5均为三角双锥结构的分子晶体,其沸点高低:PF5<PCl5 |
您最近一年使用:0次
2021-09-07更新
|
218次组卷
|
2卷引用:海南省北京师范大学万宁附属中学2021-2022学年高三上学期11月月考化学试题
解题方法
6 . 五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是
| X | Y | Z | T | |
| L |
| A.原子半径:X<Y<Z<T<L |
| B.气态氢化物的还原性:L>Z>T |
| C.X的电负性是五种元素中最小的 |
| D.Y和T组成的化合物是离子化合物 |
您最近一年使用:0次
解题方法
7 . 下列各组结构和性质对比正确的是
| A.第一电离能Li>Na | B.电负性O>F |
| C.粒子半径F->Mg2+ | D.酸性H2SO3>HNO3 |
您最近一年使用:0次
解题方法
8 . 新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiC14和LiBH4反应制得。LiBH4由Li+和BH 构成,BH
构成,BH 的立体结构是
的立体结构是_______ ,B原子的杂化轨道类型是_______ 。Li、B、H元素的电负性由大到小排列顺序为_______ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+_______ H-(填“>”、“=”或“<”)。
②某储氢材料是第三周期金属元素M的氢化物。M的部分电离能如表所示:
M是_______ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),NaH的理论密度是_______ g/cm3(只列算式,不必计算出数值,阿伏加德罗常数为NA)。
(1)Ti(BH4)3是一种储氢材料,可由TiC14和LiBH4反应制得。LiBH4由Li+和BH
 构成,BH
构成,BH 的立体结构是
的立体结构是(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+
②某储氢材料是第三周期金属元素M的氢化物。M的部分电离能如表所示:
| I1(kJ/mol) | I2(kJ/mol) | I3(kJ/mol) | I4(kJ/mol) | I5(kJ/mol) |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),NaH的理论密度是
您最近一年使用:0次
解题方法
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大,最外层电子数满足Z=X+Y;化合物Y2X4的电子总数为18个;基态Z原子的电子总数是其最高能级电子数的2倍,且最高能级有两个未成对电子;W的氢化物水溶液及最高价氧化物对应水化物均为强酸。下列叙述错误的是
| A.X、Y、W三种元素能形成离子化合物 | B.X2Y—YX2的水溶液呈碱性 |
| C.元素的电负性:Y<Z | D.Y2Z分子中只含σ键,不含π键 |
您最近一年使用:0次
2021-02-04更新
|
438次组卷
|
3卷引用:2021年海南高考化学试题变式题1-10
10 . 氮原子可以形成σ键、π键、大π键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
(1)基态氮原子价电子排布图不是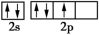 ,是因为该排布方式违背了
,是因为该排布方式违背了___________ 。
(2)肼(N2H4)的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是___________ 。
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4阴离子的空间构型为___________ 。
②写出一种与Na3NO4的阴离子互为等电子体的化学式___________ 。
(4) ①吡啶分子(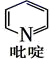 )是大体积平面配体,其结构简式如图所示,该配体的配位原子是
)是大体积平面配体,其结构简式如图所示,该配体的配位原子是___________ 。吡啶分子中,各元素的电负性由大到小的顺序为___________ ,其中碳、氮原子的轨道杂化方式分别是___________ 、___________ 。
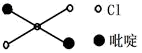
②反式二氯二吡啶合铂分子结构如图所示,该分子是___________ 分子 选填“极性”、“非极性”
选填“极性”、“非极性” 。
。
(5)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中,该晶体中铁、氮的微粒个数之比为___________ 。

(1)基态氮原子价电子排布图不是
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)肼(N2H4)的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4阴离子的空间构型为
②写出一种与Na3NO4的阴离子互为等电子体的化学式
(4) ①吡啶分子(
 )是大体积平面配体,其结构简式如图所示,该配体的配位原子是
)是大体积平面配体,其结构简式如图所示,该配体的配位原子是②反式二氯二吡啶合铂分子结构如图所示,该分子是
 选填“极性”、“非极性”
选填“极性”、“非极性”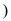 。
。
(5)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中,该晶体中铁、氮的微粒个数之比为

您最近一年使用:0次



