名校
解题方法
1 . 新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(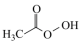 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。___________ ;基态氯原子的核外电子排布式为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
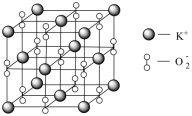
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:___________ g·cm-3 (用含a、NA的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。
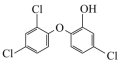
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:
您最近半年使用:0次
2 . 席夫碱A和含席夫碱A的红光铂配合物的分子结构如图所示。

A.元素的电负性大小为: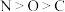 |
B.席夫碱A分子内可以形成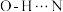 氢键 氢键 |
C.红光铂配合物分子中 的化合价为 的化合价为 |
D.红光铂配合物分子中 键的类型为离子键 键的类型为离子键 |
您最近半年使用:0次
2024-04-18更新
|
122次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
名校
3 . 某有机物在合成中具有重要作用,其分子结构如下图所示。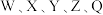 是核电荷数依次增大的短周期元素。
是核电荷数依次增大的短周期元素。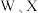 原子序数之和等于Y的原子序数,
原子序数之和等于Y的原子序数,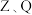 原子价电子数相同。下列说法
原子价电子数相同。下列说法错误 的是
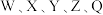 是核电荷数依次增大的短周期元素。
是核电荷数依次增大的短周期元素。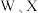 原子序数之和等于Y的原子序数,
原子序数之和等于Y的原子序数,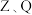 原子价电子数相同。下列说法
原子价电子数相同。下列说法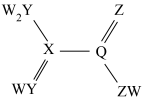
A. 元素的氢化物沸点最高的是Z 元素的氢化物沸点最高的是Z | B. 元素电负性最大的是Z 元素电负性最大的是Z |
| C.Q的最高价氧化物是酸性氧化物 | D.该有机物具有碱性 |
您最近半年使用:0次
4 . 根据表中短周期元素的有关信息判断,下列说法错误的是
元素编号 | E | F | G | H | I | J | K | L |
原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.160 | 0.186 |
| 最高化合价或最低化合价 |
|
|
|
|
|
|
|
|
| A.电负性大小:F>H>I |
| B.简单离子半径:K>F>L |
| C.第一电离能:K>J>L |
| D.L、K、J的最高价氧化物对应水化物碱性逐渐减弱 |
您最近半年使用:0次
解题方法
5 . 以电解铝废渣(主要含 、
、 、
、 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:

已知: 、
、 难溶于水,
难溶于水, 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、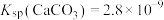 。
。
回答下列问题:
(1)基态Al原子核外电子有__________ 种不同的空间运动状态,Al原子的第一电离能低于Mg,原因是__________ 。
(2)电解氧化铝生成铝的化学方程式为__________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是__________ 。
(3)“气体1”是__________ (填化学式,下同),“滤渣1”的主要成分是__________ 。
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:__________ 。
(5)“苛化”中存在如下反应: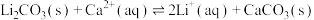 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:__________ 。
(6)已知 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:__________ 。
 、
、 、
、 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:
已知:
 、
、 难溶于水,
难溶于水, 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、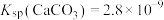 。
。回答下列问题:
(1)基态Al原子核外电子有
(2)电解氧化铝生成铝的化学方程式为
(3)“气体1”是
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:
(5)“苛化”中存在如下反应:
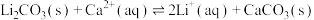 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:(6)已知
 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:
您最近半年使用:0次
名校
6 . 由原子序数依次增大的短周期主族元素X、Y、Z、R组成的一种化合物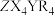 ,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
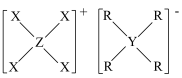
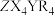 ,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
A.电负性: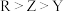 | B.键角: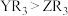 |
C.最简单氢化物的稳定性: | D.1 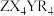 含1 含1 配位键 配位键 |
您最近半年使用:0次
2024-04-06更新
|
419次组卷
|
3卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题
名校
7 . 下列说法正确的是
| A.Ge(锗)、As(砷)、Se(硒)的电负性依次增大 |
B.硼原子核外电子由 ,原子释放能量 ,原子释放能量 |
| C.C、N、O三种元素第一电离能从大到小的顺序是O>N>C |
D.基态某原子的价层电子排布式为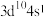 ,推断该元素位于第四周期第ⅠA族 ,推断该元素位于第四周期第ⅠA族 |
您最近半年使用:0次
2024-04-05更新
|
203次组卷
|
2卷引用:贵州省安龙县第一中学2023-2024学年高二下学期第一次阶段考试化学试题
8 . 短周期主族元素X、Y、Z、R的原子序数依次增大,其最简单氢化物的沸点如图所示。X的简单氢化物的水溶液呈碱性,R元素M层电子数是K层电子数的2倍,制备Z的氢化物时不能选用玻璃容器,X、Y、Z的最简单氢化物分子所含的电子总数相等。下列叙述正确的是
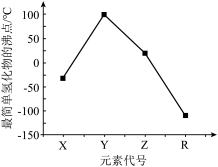

| A.电负性:Y>Z>X | B.常温常压下, 呈固态 呈固态 |
| C.最高价氧化物对应水化物的酸性:Z>X | D.最简单氢化物的键角:Y>X>R |
您最近半年使用:0次
名校
9 . X、Y、Z、W为原子序数依次增大的前四周期元素,X的核外有2个未成对电子,且无空轨道;Y是地壳中含量最多的金属元素;Z的外层电子数是最内层电子数的9倍;W的某种核素的质量数为56,中子数为30。下列说法不正确的是
| A.四种元素电负性最大的是X | B.Y和Z的氯化物中熔点较高的是Y |
| C.X、W、Y第一电离能顺序依次减小 | D.Y的最高价氧化物对应的水化物具有两性 |
您最近半年使用:0次
10 . W、X、Y、Z是电负性依次增大的前四周期主族元素。W为前四周期电负性最小的元素,X为地壳中含量第二的元素,Y的基态原子中单电子和成对电子个数比为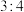 ,Z的一种单质是极性分子且常用于消毒杀菌。下列说法中正确的是
,Z的一种单质是极性分子且常用于消毒杀菌。下列说法中正确的是
A.第一电离能: |
B.氢化物的沸点: |
C.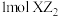 晶体中有 晶体中有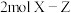 键 键 |
| D.元素X、Y、Z的最高正化合价依次升高 |
您最近半年使用:0次
2024-03-22更新
|
287次组卷
|
2卷引用:贵州省贵阳市2024届高三下学期适应性测试(一)化学试题








