名校
解题方法
1 . 第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______ 。与CN-互为等电子体的一种分子为_______ (填化学式)。
(2)Ti(BH4)2是一种储氢材料。写出基态Ti的价电子排布式_______ ,BH 的空间构型是
的空间构型是_______ 。
(3)[Cr(H2O)4Cl2]Cl·2H2O中提供孤对电子的原子为_______ ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为_______
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点FeO_______ NiO (填“>”或“<”)。
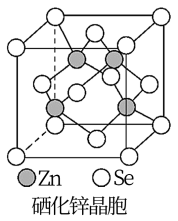
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为_______ ;若该晶胞密度为d g·cm-3, 硒化锌的摩尔质量为mg/mol。NA代表阿伏加德罗常数,则晶胞参数a为_______ cm。
(1)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为
(2)Ti(BH4)2是一种储氢材料。写出基态Ti的价电子排布式
 的空间构型是
的空间构型是(3)[Cr(H2O)4Cl2]Cl·2H2O中提供孤对电子的原子为
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点FeO
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为

您最近半年使用:0次
名校
解题方法
2 . 硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___ ,电负性由大到小顺序为___ (用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为___ ,预测砷的氢化物分子的立体结构为___ ,其沸点比NH3的___ (填“高”或“低”),其判断理由是___ 。
(3)硼及化合物应用广泛。已知BP的熔点很高,其晶胞结构如图所示。
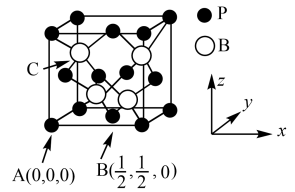
C点的原子坐标为___ ,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加 德罗常数的值,则ρ=___ g/cm3(用含d、NA的代数式表示)
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为
(2)元素氮与砷同族。基态氮元素的价电子排布式为
(3)硼及化合物应用广泛。已知BP的熔点很高,其晶胞结构如图所示。

C点的原子坐标为
您最近半年使用:0次
3 . 铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___ 族。写出其基态原子的电子排布式_____ 。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___ .(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____ 。
(3)Cu可以和EDA(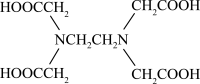 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是____ ,其中C、N、O的电负性由大到小的顺序是_____ 。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____ ,O2中σ和 键的个数比是
键的个数比是______ 。
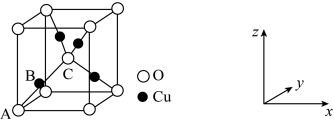
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是( ,
, ,
, ),则B原子坐标是
),则B原子坐标是____ 。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加 德罗常数的值,则氧化亚铜的密度是_____ g·cm—3
(1)Cu位于周期表第四周期第
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子
②第二电离能Cu比Ni高,原因是
(3)Cu可以和EDA(
 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为
 键的个数比是
键的个数比是②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(
 ,
, ,
, ),则B原子坐标是
),则B原子坐标是
您最近半年使用:0次
2019-09-24更新
|
254次组卷
|
3卷引用:西藏日喀则市上海实验学校2020-2021学年高三上学期第二次月考理综化学试题
解题方法
4 . 下表为周期表的一部分,其中的编号代表对应的元素。

(1)在①~⑩元素的电负性最大的是_____ (填元素符号)。
(2)⑨元素有_____ 种运动状态不同的电子。
(3)⑩的基态原子的价电子排布图为_____ 。
(4)⑤的氢化物与⑦的氢化物比较稳定的是_____ ,沸点较高的是_____ (填化学式)。
(5)上述所有元素中的基态原子中 4p轨道半充满的是_____ (填元素符号),4s轨道半充满的是_____ (填元素符号)。

(1)在①~⑩元素的电负性最大的是
(2)⑨元素有
(3)⑩的基态原子的价电子排布图为
(4)⑤的氢化物与⑦的氢化物比较稳定的是
(5)上述所有元素中的基态原子中 4p轨道半充满的是
您最近半年使用:0次
名校
5 . 在通常条件下,下列各组物质的性质排列正确的是( )
| A.Na、Mg、Al 的第一电离能逐渐增大 |
| B.热稳定性:HF>H2O>NH3 |
| C.S2﹣、Cl﹣、K+的半径逐渐增大 |
| D.O、F、N 的电负性逐渐增大 |
您最近半年使用:0次
2019-07-09更新
|
302次组卷
|
5卷引用:西藏拉萨市八校2018-2019学年高二下学期期末联考化学试题
名校
6 . 中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________ ,烟花燃放过程中,钾元素中的电子跃迁的方式是___________ ,K、S、N、O四种元素第一电离能由大到小的顺序为___________ 。上述反应涉及的元素中电负性最大的是___________ (填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为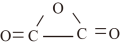 )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________ ,CO2分子的立体构型为___________ 。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________ 。
③CO分子中π键与σ键个数比为___________ 。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________ ,若晶胞参数为dpm,则该超氧化物的密度为___________ g·cm-3(用含d、NA的代数式表示,设NA表示阿伏伽德罗常数的值)。
(1)氮原子的价层电子排布图为
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为
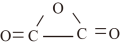 )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。①C2O3中碳原子的杂化轨道类型为
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是
③CO分子中π键与σ键个数比为
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为
您最近半年使用:0次
2019-04-03更新
|
525次组卷
|
5卷引用:西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题
解题方法
7 . 氯磺酰氰酯(结构简式为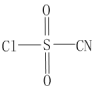 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为__________ ,组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为__________
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是__________ 、__________ , 1个氯磺酰氰酯分子中含有σ键的数目为__________ ,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为__________ 。
(3)ClO4-的空间构型为__________
(4)一种由铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为__________

 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。(1)基态钴原子的核外电子排布式为
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
(4)一种由铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为

您最近半年使用:0次
2018-09-26更新
|
289次组卷
|
2卷引用:西藏自治区拉萨市拉萨中学2019届高三第一次月考化学试题
8 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
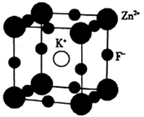
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近半年使用:0次
2018-01-07更新
|
408次组卷
|
6卷引用:西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题
9 . 下列有关元素周期表及元素周期律的说法错误的是
| A.N能层的能级数最多为3个 |
| B.Cu元素在元素周期表的ds区 |
| C.F元素在同周期中电负性最大 |
| D.根据对角线规则,铍和铝的化学性质具有相似性 |
您最近半年使用:0次
2017-02-17更新
|
397次组卷
|
7卷引用:西藏自治区拉萨中学2016-2017学年高二第七次月考化学试题
名校
解题方法
10 . 我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________ 。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________ (用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________ (选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________ ,该原子团中 键与
键与 个数的比值为
个数的比值为___________________ 。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________ 。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________ 。
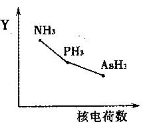
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
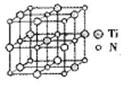
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______ 。
(1)基态Fe2+的核外电子排布式为
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为
 键与
键与 个数的比值为
个数的比值为(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有

a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为

您最近半年使用:0次
2016-12-09更新
|
624次组卷
|
3卷引用:西藏山南市第二高级中学2020届高三第三次模拟考试理综化学试题



