名校
解题方法
1 . 硼、碳、氮元素形成的化合物极为丰富。
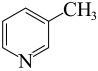
(1)吡啶( )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
(2) 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是__________ ,其原因为__________ 。
(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则__________ ,晶体类型是__________ , 与硼原子间的最短距离为
与硼原子间的最短距离为__________ cm(用含a代数式表示)。
(4)下列有关说法正确的是__________。
(1)吡啶(
 )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(2)
 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为
 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则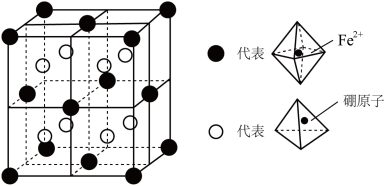
 与硼原子间的最短距离为
与硼原子间的最短距离为(4)下列有关说法正确的是__________。
| A.电负性:N>H>B | B.沸点:吡啶>苯 |
| C.第一电离能:N>C>O | D.基态 的简化电子排布式: 的简化电子排布式: |
您最近半年使用:0次
名校
2 . SiCl4与N-甲基咪唑(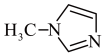 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
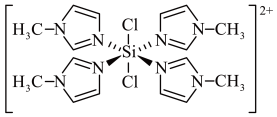
| A.N-甲基咪唑分子中氮原子的杂化轨道类型为sp2和sp3 |
| B.H、C、N的电负性由大到小的顺序为N>C>H |
| C.1个M2+中含有54个σ键(包括配键) |
| D.中心原子硅的氧化数为+6 |
您最近半年使用:0次
名校
3 . 按自由基稳定性由大到小排列的顺序是

| A.cadb | B.cdab | C.acdb | D.acbd |
您最近半年使用:0次
名校
4 . 下面关于四种短周期元素的原子比较正确的是
①基态原子的电子排布式: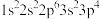 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
①基态原子的电子排布式:
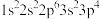 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子| A.最高正化合价:④=①>②>③ | B.原子半径:③>②>①>④ |
| C.电负性;③>②>①>④ | D.第一电离能:④>①>②>③。 |
您最近半年使用:0次
2024-04-11更新
|
167次组卷
|
2卷引用:浙江省舟山中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . 优氯净(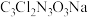 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
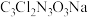 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是| A.电负性:O>N>C | B.原子半径:Cl>Na>O |
| C.O在周期表中的位置是第2周期ⅣA族 | D.热稳定性: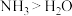 |
您最近半年使用:0次
2024-04-11更新
|
91次组卷
|
2卷引用:浙江省舟山中学2023-2024学年高二下学期4月月考化学试题
解题方法
6 . 氮、硫和氯等是构成化合物的常见元素。已知:2SO3+H2O=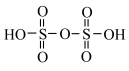 。
。
 周围最近的
周围最近的 有
有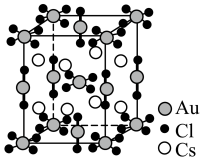
A.能量最低的激发态Cl原子的M层电子排布图为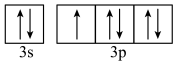 |
B.电负性: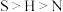 |
C. 中两个 中两个 键的镜面在空间上相互垂直 键的镜面在空间上相互垂直 |
D.第一电离能: |
(3)①
 和
和 发生如下过程:
发生如下过程: ,硫酸起到
,硫酸起到比较键角
 ,
,
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(4)将
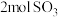 与
与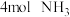 发生化合反应生成
发生化合反应生成 型离子化合物,其中A为
型离子化合物,其中A为 ,写出B的结构式
,写出B的结构式
您最近半年使用:0次
名校
解题方法
7 . 下列事实的解释不正确的是
| 事实 | 解释 | |
| A | 晶体熔点:HF>HCl | HF分子内H-F键能大于HCl分子内H-Cl键能 |
| B | 向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1-2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
| C | CH 中H-C-H键角比CH 中H-C-H键角比CH 中的大 中的大 | 中心原子的孤电子对数目CH >CH >CH ,孤电子对与成键电子对之间的斥力>成键电子对之间的斥力 ,孤电子对与成键电子对之间的斥力>成键电子对之间的斥力 |
| D | 酸性:CF3COOH>CCl3COOH | 氟的电负性大于氯的电负性,F-C的极性大于Cl-C的性,使-CF3的极性大于-CCl3的极性,导致CF3COOH的羧基中的羟基的极性更大,更易电离出H+ |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
8 . 下列说法正确的是
A.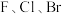 的电负性依次增大 的电负性依次增大 |
B.电子排布不同的两种氮原子: ,能量 ,能量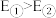 |
| C.太阳光谱中的黑线实质上是太阳中所含元素原子的发射光谱 |
D. 的最外层电子数依次增多 的最外层电子数依次增多 |
您最近半年使用:0次
2024-04-04更新
|
173次组卷
|
2卷引用:浙江省杭州市浙江大学附属中学2023-2024学年高二上学期期末考试化学试题
解题方法
9 . A、M、Q、R、X、Y为原子序数依次增大的短周期主族元素。A是所有原子中原子半径最小的,M原子核外电子有6种运动状态,R和X同主族。W是第四周期的过渡元素,W+基态离子内层轨道全部充满,最外层电子数为0.请回答下列问题:
(1)W元素位于___________ 区(填“s、p、d、ds或f”)。
(2)M、Q和R的电负性由小到大的顺序是___________ (用元素符号表示)。
(3)写出RY2的电子式___________ 。
(4)X2Y2和A2R在一定条件下发生反应,生成一种固体单质和两种具有刺激性气味的常见气体,请写出相应的化学反应方程式___________ 。
(5)A和W形成的化合物微观结构如下
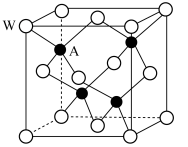
则该化合物的化学式为___________ ;离W最近的A有___________ 个;离W最近的W有___________ 个。若上述晶体的密度为Xg·cm-3,该晶体结构的边长为anm,则W的相对原子质量为___________ 。(用含NA、X、a的式子表示)
(1)W元素位于
(2)M、Q和R的电负性由小到大的顺序是
(3)写出RY2的电子式
(4)X2Y2和A2R在一定条件下发生反应,生成一种固体单质和两种具有刺激性气味的常见气体,请写出相应的化学反应方程式
(5)A和W形成的化合物微观结构如下

则该化合物的化学式为
您最近半年使用:0次
解题方法
10 . 为庆祝“国际化学元素周期表年”,中国化学会面向会员遴选118名青年化学家,作为118个化学元素的“代言人”,吕华、田振玉、翟天佑分别成为 元素的代言人。回答下列问题:
元素的代言人。回答下列问题:
(1) 三种元素的第一电离能由小到大排序为
三种元素的第一电离能由小到大排序为_______ 。
(2)氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为_______ 。
(3)下列说法正确的是_______。
(4)已知 与
与 的结构相同,在
的结构相同,在 中S的化合价为
中S的化合价为_______ , 的化合价为
的化合价为_______ 。
(5) 和S元素位于周期表的
和S元素位于周期表的_______ 区,此区元素的价层电子排布特点是_______ 。
 元素的代言人。回答下列问题:
元素的代言人。回答下列问题:(1)
 三种元素的第一电离能由小到大排序为
三种元素的第一电离能由小到大排序为(2)氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为
(3)下列说法正确的是_______。
A.N元素的电负性大于S元素, 中N元素显负价 中N元素显负价 |
B. 的键能强于 的键能强于 的键能, 的键能, 的热稳定性强于 的热稳定性强于 |
C. 与 与 化合通常需要高温高压催化剂,而S与 化合通常需要高温高压催化剂,而S与 化合一般只需要点燃,说明S元素的非金属性强于N元素 化合一般只需要点燃,说明S元素的非金属性强于N元素 |
D.在冰醋酸中 的酸性强于 的酸性强于 ,说明S的非金属强于N元素 ,说明S的非金属强于N元素 |
 与
与 的结构相同,在
的结构相同,在 中S的化合价为
中S的化合价为 的化合价为
的化合价为(5)
 和S元素位于周期表的
和S元素位于周期表的
您最近半年使用:0次



