1 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为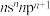 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能___________ (填“<”“>”或“=”)B元素的第一电离能, A、B、C三种元素的电负性由小到大的顺序为___________ (用元素符号表示)。
(2)D元素原子的价电子排布式是___________ 。
(3)C元素的电子排布图为___________ ;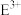 的离子符号为
的离子符号为___________ 。
(4)F元素位于元素周期表的___________ 区,其基态原子的电子排布式为___________ 。
(5)G元素可能的性质___________。
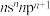 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A元素的第一电离能
(2)D元素原子的价电子排布式是
(3)C元素的电子排布图为
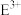 的离子符号为
的离子符号为(4)F元素位于元素周期表的
(5)G元素可能的性质___________。
| A.其单质可作为半导体材料 | B.其电负性大于磷 |
| C.其原子半径大于锗 | D.其第一电离能小于硒 |
您最近半年使用:0次
2 . 完成下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________
(2)①基态Cu原子有___________ 种不同能级的电子。位于在周期表___________ 区(填s、p、d或ds)。Cu+的价电子排布式为___________ 。
②N原子中最高能级的电子的电子云轮廓图为___________ 。
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ 。
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:___________ 。
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用___________ 盛装(填 酸式滴定管 或 碱式滴定管)滴定终点溶液的判断是___________ 颜色变化为由无色变为浅红色。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①基态Cu原子有
②N原子中最高能级的电子的电子云轮廓图为
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中
 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用
您最近半年使用:0次
3 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。下列有关说法正确的是

A.电负性由大到小的顺序: |
B. 中 中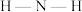 的键角大于该配合物中 的键角大于该配合物中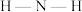 的键角 的键角 |
| C.该物质中存在的化学键有配位键、共价键、氢键 |
| D.从分子结构的角度分析可知甘氨酸易溶于水 |
您最近半年使用:0次
解题方法
4 . 物质的结构决定物质的性质,下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 溶解度(25℃):S(Na2CO3)>S(NaHCO3) | 有无氢键 |
| B | pKa:一氯乙酸>二氯乙酸>三氯乙酸 | 羟基的极性 |
| C | 碱性(结合H+的能力):NH3>NF3 | 成键元素的电负性 |
| D | 熔点:金刚石>晶体硅 | 晶体类型 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
5 . 短周期主族元素X、Y、Z、R的原子序数依次增大,某种性质递变规律如图所示,下列元素性质与元素对应正确的是

| A.原子半径:F、Cl、Br、I | B.电负性:Si、P、S、Cl |
| C.第一电离能:Si、P、S、Cl | D.最高化合价:C、N、O、F |
您最近半年使用:0次
2024-04-13更新
|
485次组卷
|
3卷引用:甘肃省靖远县2024届高三下学期第三次联考化学试题
名校
解题方法
6 . 氨硼烷(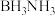 )是一种重要的储氢材料。1955年,Shore和Parry首次合成出氨硼烷。其反应如下:
)是一种重要的储氢材料。1955年,Shore和Parry首次合成出氨硼烷。其反应如下: 。下列说法错误的是
。下列说法错误的是
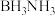 )是一种重要的储氢材料。1955年,Shore和Parry首次合成出氨硼烷。其反应如下:
)是一种重要的储氢材料。1955年,Shore和Parry首次合成出氨硼烷。其反应如下: 。下列说法错误的是
。下列说法错误的是A.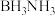 和 和 中均含有配位键 中均含有配位键 |
B.基态N原子核外价层电子排布图: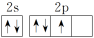 |
| C.上述反应涉及的第二周期元素中,电负性最大的是N |
D. 和 和 中, 中, 与 与 具有相似的空间结构 具有相似的空间结构 |
您最近半年使用:0次
2024-04-07更新
|
338次组卷
|
4卷引用:甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题
名校
7 . 在1778年,法国马厚比无意中发现用硫酸钠、木炭和铁(后改用氧化铁)一起灼烧,再用水滗取可得到纯碱。这一发明使他建立起世界上第一座纯碱工厂。
2Fe2O3+3NazSO4+16C Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+O2+2CO2 Na2Fe4S3+2Na2CO3
Na2Fe4S3+2Na2CO3
回答下列问题:
(1)基态铁原子的价层电子排布式为_______ ,其3d能级上有_______ 个运动状态不同的电子。
(2)基态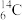 原子核外有
原子核外有_______ 对自旋方向相反的电子对。基态钠原子核外电子占据能量最高的能级符号是_______ 。
(3)在氧、硫、钠、碳、铁元素中,金属性最强的元素与非金属性最强的元素组成的化合物是_______ (填化学式)。C、O、F三种元素中,电负性由大到小的顺序为_______ 。
(4)某同学书写的基态碳原子轨道表示式为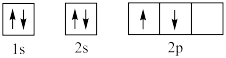 ,他违背了
,他违背了_______ 。
2Fe2O3+3NazSO4+16C
 Na6Fe4S3+ 14CO↑+2CO2↑
Na6Fe4S3+ 14CO↑+2CO2↑Na6Fe4S3+O2+2CO2
 Na2Fe4S3+2Na2CO3
Na2Fe4S3+2Na2CO3回答下列问题:
(1)基态铁原子的价层电子排布式为
(2)基态
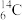 原子核外有
原子核外有(3)在氧、硫、钠、碳、铁元素中,金属性最强的元素与非金属性最强的元素组成的化合物是
(4)某同学书写的基态碳原子轨道表示式为
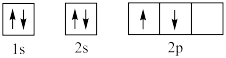 ,他违背了
,他违背了
您最近半年使用:0次
名校
8 . 短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15.基态Y原子的最外层电子数是其内层电子数的3倍,Y与Z同主族,Z与W同周期。下列说法正确的是
| A.简单氢化物的沸点:H2Z>H2Y |
| B.电负性由大到小的顺序是Y>Z>X |
| C.化合物WX2中既存在离子键,又存在共价键 |
| D.W元素基态原子核外M层电子的自旋状态相同 |
您最近半年使用:0次
解题方法
9 . 化合物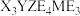 所含的5种元素均为短周期主族元素,
所含的5种元素均为短周期主族元素, 、
、 和
和 为同周期元素,原子序数依次增加,
为同周期元素,原子序数依次增加, 的基态原子价层电子排布式为
的基态原子价层电子排布式为 ,
, 的基态原子价层
的基态原子价层 轨道半充满,
轨道半充满, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 是有机分子的骨架元素,下列说法正确的是
是有机分子的骨架元素,下列说法正确的是
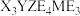 所含的5种元素均为短周期主族元素,
所含的5种元素均为短周期主族元素, 、
、 和
和 为同周期元素,原子序数依次增加,
为同周期元素,原子序数依次增加, 的基态原子价层电子排布式为
的基态原子价层电子排布式为 ,
, 的基态原子价层
的基态原子价层 轨道半充满,
轨道半充满, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 是有机分子的骨架元素,下列说法正确的是
是有机分子的骨架元素,下列说法正确的是A.元素电负性: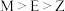 |
B.简单氢化物沸点: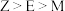 |
C.第一电离能: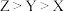 |
D. 和 和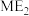 的空间结构均为直线形 的空间结构均为直线形 |
您最近半年使用:0次
2024-04-04更新
|
709次组卷
|
2卷引用:甘肃省武山县第一高级中学2023-2024学年高二下学期第一次月考化学试卷
名校
10 . 下列说法中正确的是
| A.电子云图中的小黑点密表示该核外空间的电子多 |
B.电子排布式 违反了洪特规则 违反了洪特规则 |
| C.原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大 |
| D.电子仅由激发态跃迁到基态时才会产生原子光谱 |
您最近半年使用:0次
2024-04-04更新
|
194次组卷
|
2卷引用:甘肃省武山县第一高级中学2023-2024学年高二下学期第一次月考化学试卷



