1 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是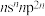 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:___________ 。
②B、C、D、E 4种元素的第一电离能由大到小顺序为:___________ 。
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。
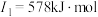
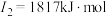
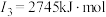
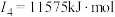
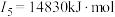
(3)F在周期表中的位置___________ ,位于周期表的___________ 区。
(4)BA3是一种很好的配体,BA3的沸点___________ (填“>”“=”或“<”)AsA3。
(5)B原子核外有___________ 种不同运动状态的电子;基态B原子中,能量最高的电子所占据的原子轨道的形状为___________ ;F原子核外电子占据的最高能层的符号是___________ 。
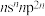 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:
②B、C、D、E 4种元素的第一电离能由大到小顺序为:
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是
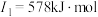
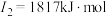
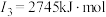
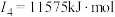
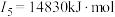
(3)F在周期表中的位置
(4)BA3是一种很好的配体,BA3的沸点
(5)B原子核外有
您最近半年使用:0次
名校
解题方法
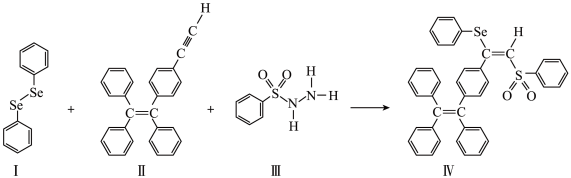
2 . 硒(Se是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子的合成路线如下:
(1)基态硒原子的价电子排布式为_______ 。
(2)比较沸点
_______  (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因_______ 。
(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
(4) 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有_______ mol孤电子对。
(5)适量的硒酸钠 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为____ 。结合无机含氧酸的酸性变化规律,比较酸性:
_____  (填“>”或“<”)。
(填“>”或“<”)。
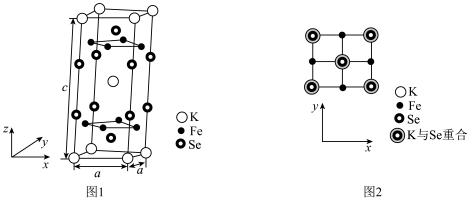
(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。_______ 个。
②该晶胞参数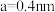 、
、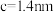 ,该晶体密度
,该晶体密度
_______  。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
(1)基态硒原子的价电子排布式为
(2)比较沸点

 (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
A.Ⅰ中Se原子为 杂化,碳原子不都是 杂化,碳原子不都是 杂化 杂化 |
| B.Ⅱ是由极性键和非极性键组成的弱极性分子 |
| C.Ⅲ含有的所有元素中,O的电负性最大 |
| D.Ⅳ中含有2个手性碳原子 |
(4)
 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有(5)适量的硒酸钠
 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为
 (填“>”或“<”)。
(填“>”或“<”)。(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
②该晶胞参数
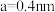 、
、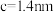 ,该晶体密度
,该晶体密度
 。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
您最近半年使用:0次
3 . 钛被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域,如氮化钛和钛的卤化物。
(1)基态Ti原子的价电子排布图为_______ ;前10号元素中,第一电离能比N大的元素有______ 种。
(2)Ti(IV)的极化能力强,不能从水溶液中获得其含氧酸正盐,只能得到水解产物如TiOSO4和TiO(NO3)2。其中阴离子SO 的空间构型为
的空间构型为_______ ,NO 中心原子的杂化方式为
中心原子的杂化方式为______ ,TiOSO4组成元素的电负性由大到小顺序是_______ 。
(3)TiF4和TiCl4熔点如表所示,二者熔点相差较大的原因是______ 。
(4)在浓TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为1:2,则由该配合离子组成的晶体化学式还可以写为_______ 。
(5)氨化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有_______ 个;若该晶胞的密度为ρg•cm-3,阿伏加德罗常数的值为NA,则晶胞中Ti原子与N原子的最近距离为_______ nm(用含ρ,NA的代数式表示)
(1)基态Ti原子的价电子排布图为
(2)Ti(IV)的极化能力强,不能从水溶液中获得其含氧酸正盐,只能得到水解产物如TiOSO4和TiO(NO3)2。其中阴离子SO
 的空间构型为
的空间构型为 中心原子的杂化方式为
中心原子的杂化方式为(3)TiF4和TiCl4熔点如表所示,二者熔点相差较大的原因是
| 化合物 | TiF4 | TiCl4 |
| 熔点/℃ | 377 | -24.12 |
(4)在浓TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为1:2,则由该配合离子组成的晶体化学式还可以写为
(5)氨化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有
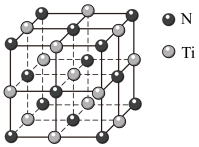
您最近半年使用:0次
4 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。
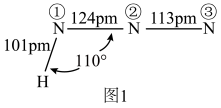
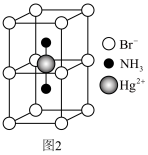
(4)某含氮化合物晶胞结构如图2所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg2+,相邻Br-的距离均为apm,阿伏加德罗常数的值为NA。该物质的化学式为_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是

(4)某含氮化合物晶胞结构如图2所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg2+,相邻Br-的距离均为apm,阿伏加德罗常数的值为NA。该物质的化学式为
 cm3。
cm3。
您最近半年使用:0次
名校
5 . 过渡金属元素铬( )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
(1)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是_____ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布简式应为
B. 电子能量较高,总是在比
电子能量较高,总是在比 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是______ ,中心离子的配位数为_____ 。
(3) 中配体分子
中配体分子 以及
以及 分子的空间结构如图所示。
分子的空间结构如图所示。
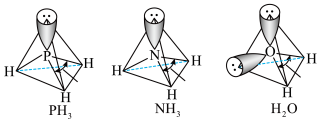
 中
中 的杂化类型是
的杂化类型是______ 。 的沸点比
的沸点比 的
的______ ,原因是________  的键角
的键角______ (填“大于”“小于”或“等于”) 的键角。
的键角。
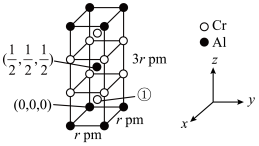
(4)铝与铬可形成如图所示的晶胞,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称为原子分数坐标。则①铬原子的原子分数坐标为________ 。
 )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:(1)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布简式应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比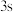 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 以及
以及 分子的空间结构如图所示。
分子的空间结构如图所示。
 中
中 的杂化类型是
的杂化类型是 的沸点比
的沸点比 的
的 的键角
的键角 的键角。
的键角。(4)铝与铬可形成如图所示的晶胞,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称为原子分数坐标。则①铬原子的原子分数坐标为

您最近半年使用:0次
名校
6 . 短周期元素 的原子序数依次递增,
的原子序数依次递增,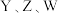 位于同周期,上述部分元素组成物质存在如图所示转化关系。
位于同周期,上述部分元素组成物质存在如图所示转化关系。

下列说法错误的是
 的原子序数依次递增,
的原子序数依次递增,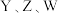 位于同周期,上述部分元素组成物质存在如图所示转化关系。
位于同周期,上述部分元素组成物质存在如图所示转化关系。
下列说法错误的是
A.第一电离能: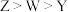 | B.简单氢化物的沸点: |
C.电负性: | D.转化关系中 原子的杂化方式有 原子的杂化方式有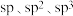 |
您最近半年使用:0次
7 . 现有四种元素的基态原子的电子排布式如下:① ;②
;②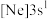 ;③
;③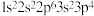 ;④
;④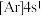 。则下列说法中正确的是
。则下列说法中正确的是
 ;②
;②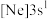 ;③
;③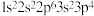 ;④
;④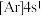 。则下列说法中正确的是
。则下列说法中正确的是| A.①和③元素均为非金属元素,并且位于同一主族 |
| B.②号元素的单质具有强氧化性 |
C.第一电离能: |
D.电负性: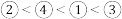 |
您最近半年使用:0次
2024-02-11更新
|
275次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高二上学期期末教学质量检测化学试卷
8 . 医疗上常用 作为
作为 射线透视肠胃的内服药剂,俗称“钡餐”。下列说法正确的是
射线透视肠胃的内服药剂,俗称“钡餐”。下列说法正确的是
 作为
作为 射线透视肠胃的内服药剂,俗称“钡餐”。下列说法正确的是
射线透视肠胃的内服药剂,俗称“钡餐”。下列说法正确的是| A.基态硫原子有4个未成对电子 |
B.电负性: |
C.离子半径: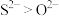 |
D.氢化物的稳定性: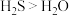 |
您最近半年使用:0次
解题方法
9 . 铬及其化合物被广泛应用于冶金、化工、铸铁、耐火及高科技等领域。
(1)基态铬原子的价电子排布式为_______ 。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是________ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是_______ 。(填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是______ ,中心铬的配位数为_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是___________ 。
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是______ (填字母)。
a.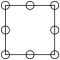 b.
b. 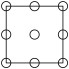 c.
c. 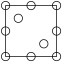 d.
d.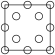
②晶胞中 N 原子的坐标是 A(0,0,0),B( ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是_______ 。
(1)基态铬原子的价电子排布式为
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是
a.
 b.
b.  c.
c.  d.
d.
②晶胞中 N 原子的坐标是 A(0,0,0),B(
 ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是
您最近半年使用:0次
解题方法
10 . 铜、锌原子结构的特殊性,决定了它们的单质及其化合物在化工生产中发挥着重要的作用,回答下列问题。
(1)基态锌原子的价电子排布式为___________ ,基态 的核外电子存在
的核外电子存在___________ 种不同的空间运动状态。
(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
① 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为___________ ;阴离子中心原子的杂化轨道类型是___________ ,空间构型为___________ 。
② 中
中 的键角比独立
的键角比独立 的键角
的键角___________ (填“大”“小”或“相等”),原因是___________ 。
(3) 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为___________ 。
(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为 。
。
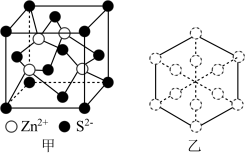
①两个S原子之间的最短距离为___________ nm(已知 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。
②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为___________ 。
(1)基态锌原子的价电子排布式为
 的核外电子存在
的核外电子存在(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
①
 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为②
 中
中 的键角比独立
的键角比独立 的键角
的键角(3)
 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为
 。
。
①两个S原子之间的最短距离为
 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为
您最近半年使用:0次



