1 . 在碱性溶液中, 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
| A.该配离子中非金属元素的电负性大小顺序有O>N>C>H |
| B.该配离子中铜离子的配位数为4 |
C.该配离子中N与C的杂化类型分别为 和 和 |
| D.该配离子存在的化学键类型有离子键、共价键、配位键、氢键 |
您最近半年使用:0次
2 . 短周期元素W、X、Y、Z的原子序数依次增大,W、Y、Z可形成结构如图所示的分子,W与Y元素是位于同主族的非金属元素,X是所在短周期中原子半径最大的元素。下列说法不正确的是
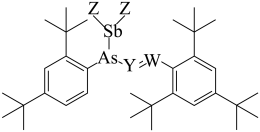

| A.元素W的气态氢化物中W的杂化方式为sp3杂化 |
| B.元素X、Y、Z的电负性:X<Y<Z |
| C.同周期主族元素中第一电离能比Y高的元素只有一种 |
| D.X的氧化物均为碱性氧化物 |
您最近半年使用:0次
3 . 硼的化合物有重要应用。
(1)H3BO3的层内结构如图所示,虚线部分表示存在______ 键。

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为______ 。写出BCl3水解的化学方程式_______ 。
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式________ 。
(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为________ 。NH3BH3分子间存在“双氢键”使氨硼烷的熔点明显升高,“双氢键”能形成的原因是_______ 。
(1)H3BO3的层内结构如图所示,虚线部分表示存在

(2)H3BO3可由BCl3水解得到。依据价层电子对互斥理论(VSEPR)推测,BCl3的空间结构的名称为
(3)H3BO3是一元酸,在水溶液中硼酸的电离方程式为:H3BO3+H2O
 [B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式
[B(OH)4]-+H+。皮肤上不小心碰到氢氧化钠溶液,一般先用大量的水冲洗,然后再涂上硼酸溶液,写出硼酸溶液与氢氧化钠反应的离子方程式(4)氨硼烷(NH3BH3)是一种有潜力的固体储氢材料。NH3BH3中N为-3价,B为+3价。H、B、N电负性由大到小的顺序为
您最近半年使用:0次
解题方法
4 . 电负性最大的元素是
| A.Na | B.F | C.H | D.Cl |
您最近半年使用:0次
名校
5 . 类比法是一种学习化学的重要方法。下列“类比”中不合理的是
A. 与HCl反应生成 与HCl反应生成 ,则 ,则 也可与HCl反应生成 也可与HCl反应生成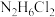 |
B. 溶液显碱性,则 溶液显碱性,则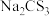 溶液显碱性 溶液显碱性 |
C.酸性: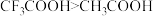 ,则碱性: ,则碱性: |
D. 沸点比 沸点比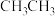 高,则苯酚的沸点比苯高 高,则苯酚的沸点比苯高 |
您最近半年使用:0次
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态 Y 原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物| 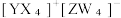 下列叙述正确的是
下列叙述正确的是
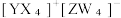 下列叙述正确的是
下列叙述正确的是| A.氧化性:Y2>W2 | B.电负性:Y>X>Z |
| C.YW3的空间结构为平面三角形 | D.第一电离能:Y<W |
您最近半年使用:0次
2023-10-17更新
|
469次组卷
|
4卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
7 .  晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
 晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是A.基态原子未成对电子数: |
B.电负性: |
C. 存在非极性健 存在非极性健 |
D.基态 原子核外电子的运动状态有5种 原子核外电子的运动状态有5种 |
您最近半年使用:0次
2023-09-10更新
|
103次组卷
|
2卷引用:新疆生产建设兵团第二中学2023-2024学年高三上学期12月月考化学题
名校
解题方法
8 . A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)A元素基态原子占据最高能级的电子云轮廓图为_______ ;B元素原子中未成对电子为_______ 。
(2)写出C元素基态原子的电子排布式:_______ 。
(3)D元素的价层电子排布图为:_______ 。
(4)元素B与D的电负性的大小关系是B_______ (填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E_______ C。
(1)A元素基态原子占据最高能级的电子云轮廓图为
(2)写出C元素基态原子的电子排布式:
(3)D元素的价层电子排布图为:
(4)元素B与D的电负性的大小关系是B
您最近半年使用:0次
名校
解题方法
9 . 铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是_______ 。
②乳酸分子(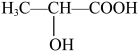 )中 σ 键与π键的数目比为
)中 σ 键与π键的数目比为_______ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为_______ 。
④C与O中,第一电离能较大的是_______ 。
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为_______ 。
②NH3的空间构型是_______ ,其中N原子的杂化方式是_______ 。
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
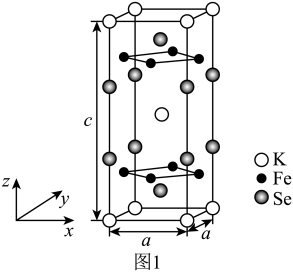
①该超导材料的化学式是_______ 。
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=_______ g·cm-3。(用 NA表示阿伏加德罗常数,写出计算表达式即可)
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是
②乳酸分子(
 )中 σ 键与π键的数目比为
)中 σ 键与π键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
④C与O中,第一电离能较大的是
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为
②NH3的空间构型是
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。

①该超导材料的化学式是
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=
您最近半年使用:0次
10 . 钛被称为继铁、铝之后的“第三金属” ,其单质及化合物具有优异的性能。
(1)钛镍合金可用于战斗机的油压系统。基态Ti原子价电子排布图为___________ 。与Ni同周期元素的基态原子中,未成对电子数与镍相同的元素有___________ 种。
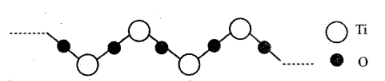
(2)硫酸氧钛是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,则该阳离子的化学式为___________ 。与 个互为等电子体的分子的化学式为
个互为等电子体的分子的化学式为___________ 。(任写一种)
(3)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。
①上述配位原子的电负性由小到大的顺序是___________ (写元素符号),
②1 mol[Ti( H2O)6]Cl3中含有σ键的数目是___________ NA。
③[ Ti(NH3)6]Cl3,中∠H-N-H___________ (填“大于”“小于”或“等于”)单个氨气分子中∠H-N-H,原因是___________ 。
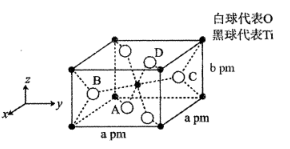
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中D、B的原子坐标为(0.69,0. 69,0),(0.81,0. 19,0.5)。 已知晶胞含对称中心,则A原子坐标为___________ 。 该晶胞中B、C两个氧原子之间的核间距d=___________ pm。阿伏伽德罗常数为NA,该晶胞的密度为___________ g·cm-3。
(1)钛镍合金可用于战斗机的油压系统。基态Ti原子价电子排布图为
(2)硫酸氧钛是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,则该阳离子的化学式为
 个互为等电子体的分子的化学式为
个互为等电子体的分子的化学式为
(3)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。
①上述配位原子的电负性由小到大的顺序是
②1 mol[Ti( H2O)6]Cl3中含有σ键的数目是
③[ Ti(NH3)6]Cl3,中∠H-N-H
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中D、B的原子坐标为(0.69,0. 69,0),(0.81,0. 19,0.5)。 已知晶胞含对称中心,则A原子坐标为

您最近半年使用:0次



