解题方法
1 . 金属钛及其化合物被广泛应用于飞机、火箭、导弹、人造卫星、宇宙飞船、舰艇、军工、医疗以及石油化工等领域,人们称钛为“21世纪金属”。自然界中钛的一种存在形式为金红石(主要成分是TiO2)。回答下列问题:
(1)基态钛原子的价电子排布式为__________________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的元素分别是_________________ (填元素符号)。
(2)钛的硬度大于铝,其原因是_________________________ 。
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态TiCl4属于___________ 晶体。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是______ ,B原子的杂化轨道类型是___________ 。
(4)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体[TiCl(H2O)5]Cl2·H2O。该晶体所含元素中,电负性最大的元素是___________ ,与Ti形成配位键的配体是___________ ,1mol该配合物中含有σ键的数目为___________ 。
(5)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示(晶胞中相同位置的原子相同),其中A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,_____ ,______ ),钛氧键的键长d=___________ (用代数式表示)。

(1)基态钛原子的价电子排布式为
(2)钛的硬度大于铝,其原因是
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态TiCl4属于
②LiBH4由Li+和BH4-构成,BH4-的空间构型是
(4)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体[TiCl(H2O)5]Cl2·H2O。该晶体所含元素中,电负性最大的元素是
(5)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示(晶胞中相同位置的原子相同),其中A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,

您最近半年使用:0次
真题
名校
2 . 在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
| A.Li,F | B.Na,F | C.Na,Cl | D.Mg,O |
您最近半年使用:0次
2019-01-30更新
|
742次组卷
|
19卷引用:贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题
贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2013-2014河北省唐山一中下学期高二期末考试化学试卷2015-2016学年陕西省西安高中高二下期末化学试卷【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)(已下线)模块同步卷06 阶段性检测卷-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省福州高级中学2020-2021学年高二下学期期中考试化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题四川省绵阳中学2022-2023学年高二上学期9月线上测试化学试题2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2上海中学东校2023-2024学年高三上学期9月月考化学试题
3 . 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
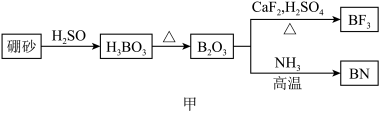
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
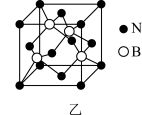
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近半年使用:0次
2019-01-30更新
|
2619次组卷
|
14卷引用:2015-2016学年贵州省思南中学高二下第二次月考化学试卷
2015-2016学年贵州省思南中学高二下第二次月考化学试卷贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题2011年普通高等学校招生全国统一考试化学卷(新课标)(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年河南灵宝第三高级中学高二下学期第三次检测化学卷(已下线)2014高考名师推荐化学选做题练习22016届重庆市部分中学高三上学期第一次月考化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题
4 . 研究发现,在CO2低压合成甲醇的反应CO2+3H2===CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为______________________ ;
元素Mn与O中,第一电离能较大的是______________________ 。
(2)CO2分子中C原子的杂化形式为______________________ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为___________ ,原因是_______________________________________________________ 。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______________________ 。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为___________ nm。MnO也属于NaCl型结构,晶胞参数为a=0.448m,则r(Mn2+)为___________ nm。
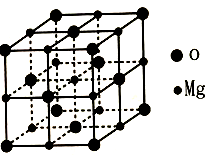
(1)Co基态原子核外电子排布式为
元素Mn与O中,第一电离能较大的是
(2)CO2分子中C原子的杂化形式为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为

您最近半年使用:0次
5 . 有A、B、C、D四种元素,常温下A的单质是深红棕色的液体,B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子总数的2倍。C、D元素原子最外层电子数相同,D元素原子核内质子数是C元素原子核内质子数的2倍。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①__________________ ;②____________________ 。
(2)写出各元素原子的电子排布式:A_____________ ,B______________ ,C____________ ,D____________ 。
(3)比较C、D两元素的性质:①第一电离能:C________ D(填“<”或“>”,下同);②电负性:C________ D;③非金属性:C________ D;④原子半径:C________ D。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①
(2)写出各元素原子的电子排布式:A
(3)比较C、D两元素的性质:①第一电离能:C
您最近半年使用:0次
6 . 碳、氧、硅、锗、氟、氯、溴、镍元素在化学中占有极其重要的地位。
(1)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________ 。
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强至弱的顺序为____________________ 。
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为__________________ 。
(4)基态锗(Ge)原子的电子排布式是____________ ,Ge的最高价氯化物分子式是________ 。该元素可能的性质或应用有________ (填字母)。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.锗的第一电离能高于碳而电负性低于碳
(5)溴与氯能以________ 键结合形成BrCl,BrCl分子中,________ 显正电性。BrCl与水发生反应的化学方程式为______________________________________________ 。
(1)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强至弱的顺序为
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(4)基态锗(Ge)原子的电子排布式是
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.锗的第一电离能高于碳而电负性低于碳
(5)溴与氯能以
您最近半年使用:0次
2019-01-11更新
|
703次组卷
|
7卷引用:贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题
7 . X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子价电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)Y、Q的元素符号依次为__ 、__ ;
(2)Y与Z的第一电离能大小关系是(用元素符号回答)__ ;
(3)X、Y、Z两两组合可形成很多等电子体,请任意写出两组等电子体__ 、__ ;
(4)Q在元素周期表 区,其价电子排布图为__ .
(5)X与W的电负性大小关系是(用元素符号回答)__ ,这两种元素组成的一种化合物是一种常见的溶剂,其电子式为__ .
(1)Y、Q的元素符号依次为
(2)Y与Z的第一电离能大小关系是(用元素符号回答)
(3)X、Y、Z两两组合可形成很多等电子体,请任意写出两组等电子体
(4)Q在元素周期表 区,其价电子排布图为
(5)X与W的电负性大小关系是(用元素符号回答)
您最近半年使用:0次
名校
8 . 元素的性质呈现周期性变化的根本原因是( )
| A.原子半径呈周期性变化 |
| B.元素的化合价呈周期性变化 |
| C.元素的电负性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
您最近半年使用:0次
2018-12-19更新
|
121次组卷
|
3卷引用:贵州省普定县一中2018-2019学年高二上学期期中考试化学试题
名校
9 . 短周期中五种元素A,B,C,D,E原子序数依次增大,其中A,B,C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B,C,D,E四种元素的原子,半径从大到小的顺序是__ (填元素符号或化学式,下同);第一电离能从大到小的顺序是__
(2)C原子的电子排布图__ ,D2﹣的结构示意图__ .A,D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式__ ,分子中含有__ 键(填“极性”或“非极性”,下同)是__ 分子.
(3)A,B,D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式__ ,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为__ 杂化,空间构型为__ .
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为__ ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为__ .
(1)B,C,D,E四种元素的原子,半径从大到小的顺序是
(2)C原子的电子排布图
(3)A,B,D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为
您最近半年使用:0次
名校
10 . Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__ (填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________ .
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
①H、O、N三种元素的电负性从大到小的顺序____ 。
②乙二胺分子中N原子成键时采取的杂化类型是__ 。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
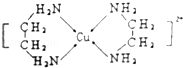
①H、O、N三种元素的电负性从大到小的顺序
②乙二胺分子中N原子成键时采取的杂化类型是
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是
您最近半年使用:0次
2018-12-17更新
|
284次组卷
|
5卷引用:贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题



