有A、B、C、D四种元素,常温下A的单质是深红棕色的液体,B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子总数的2倍。C、D元素原子最外层电子数相同,D元素原子核内质子数是C元素原子核内质子数的2倍。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①__________________ ;②____________________ 。
(2)写出各元素原子的电子排布式:A_____________ ,B______________ ,C____________ ,D____________ 。
(3)比较C、D两元素的性质:①第一电离能:C________ D(填“<”或“>”,下同);②电负性:C________ D;③非金属性:C________ D;④原子半径:C________ D。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①
(2)写出各元素原子的电子排布式:A
(3)比较C、D两元素的性质:①第一电离能:C
更新时间:2019-01-14 00:09:23
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】氮及其化合物在自然界中存在循环,请回答下列问题:
(1)氮元素在周期表中的位置是_______ ,氮原子核外电子共占据_______ 个轨道,最外层有_______ 种不同能量的电子。
(2)氨气分子的空间构型为_______ ,氮的最高价氧化物对应水化物的酸性比磷酸的酸性_______ (填“强”或者“弱”)。
(3)工业合成氨反应的化学平衡常数表达式为_______ 。一定条件下,在容积为2L的密闭容器中模拟该反应,测得10min时氮气为0.195mol,请计算0 ~ 10min的氨气的化学反应速率为_______ 。据图判断,反应进行至20 min时,曲线发生变化的原因是_______ (用文字表达)。

(4)工业上用氨水吸收SO2尾气,若最终得到(NH4)2SO4,则该溶液中c(NH )与c(SO
)与c(SO )之比
)之比_______ 2:1(选填“>”、“<”、“=”),请结合离子方程式解释其原因_______ 。
(1)氮元素在周期表中的位置是
(2)氨气分子的空间构型为
(3)工业合成氨反应的化学平衡常数表达式为

(4)工业上用氨水吸收SO2尾气,若最终得到(NH4)2SO4,则该溶液中c(NH
 )与c(SO
)与c(SO )之比
)之比
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。第四周期未成对电子数最多的元素是___________ (填元素符号)
(2)N的基态原子核外电子排布式为___________ ;Cu的原子结构示意图为___________ 。
(3)钒(23V)是元素广泛用于催化及钢铁工业。钒在元素周期表中的位置为第___________ 周期第___________ 族,其价层电子的轨道表示式为___________ 。
(4)Na位于元素周期表第___________ 周期第___________ 族;S的基态原子核外有___________ 个未成对电子。
(5)Cu2+基态核外电子排布式为___________ 。
(6)基态Fe原子有___________ 个未成对电子,Fe3+的电子排布式为___________ 。
(7)以氮化镓(GaN)等为代表的第三代半导体材料具有优异性能,31Ga基态原子的核外电子排布式是___________ 。
(8)铝原子核外电子共有___________ 种不同运动状态的电子。
(9)基态Mn2+的核外电子排布式为___________ 。
(10)Se原子序数为___________ ,其核外M层电子的排布式为___________ 。
(11)可正确表示原子轨道的是___________。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)N的基态原子核外电子排布式为
(3)钒(23V)是元素广泛用于催化及钢铁工业。钒在元素周期表中的位置为第
(4)Na位于元素周期表第
(5)Cu2+基态核外电子排布式为
(6)基态Fe原子有
(7)以氮化镓(GaN)等为代表的第三代半导体材料具有优异性能,31Ga基态原子的核外电子排布式是
(8)铝原子核外电子共有
(9)基态Mn2+的核外电子排布式为
(10)Se原子序数为
(11)可正确表示原子轨道的是___________。
| A.2s | B.2d | C.3pz | D.3f |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】氮元素及其化合物在生产、生活中用途广泛。回答下列问题:
(1)基态氮原子的价电子排布式为___________ 。
(2)与N同周期的元素中第一电离能比N大的元素有____________ 种。
(3)三硝基胺N(NO2)3(其结构为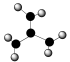 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为___________ ,并且与三个硝基中的N构成___________ 形。
(4)(CN)2、(SCN)2的性质与卤素单质的相似,称为拟卤素。其分子内各原子均达到8电子稳定结构,则1mol(CN)2分子中含___________ molπ键,SCN-的空间构型为___________ 形。
(5)白磷在氯气中燃烧可以得到PCl3和PCl5,研究发现固态PCl4和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因:___________ 。
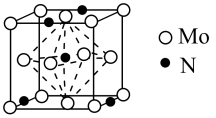
(6)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将N2还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为anm,则该晶体的化学式为___________ ,晶体的密度为___________ (列出计算式)g·cm-3。
(1)基态氮原子的价电子排布式为
(2)与N同周期的元素中第一电离能比N大的元素有
(3)三硝基胺N(NO2)3(其结构为
 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为(4)(CN)2、(SCN)2的性质与卤素单质的相似,称为拟卤素。其分子内各原子均达到8电子稳定结构,则1mol(CN)2分子中含
(5)白磷在氯气中燃烧可以得到PCl3和PCl5,研究发现固态PCl4和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的原因:
(6)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将N2还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为anm,则该晶体的化学式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】A~H元素在周期表中的位置如图所示,回答下列问题:

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁______ (填“吸收”或“释放”)能量有关。
(2)第一电离能介于C、D之间的第二周期元素有_______ 种。
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有_______ 种。
(4)D的某种氢化物(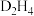 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: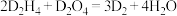 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有_______  。
。
(5) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,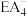 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为______ ;离子半径:
______  (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在______ (填字母)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(6)F元素能形成多种含氧酸及盐,其中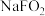 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子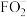 的价层电子对数为
的价层电子对数为______ ,空间构型为______ 。

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁
(2)第一电离能介于C、D之间的第二周期元素有
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有
(4)D的某种氢化物(
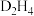 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: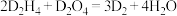 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有 。
。(5)
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,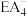 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为
 (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(6)F元素能形成多种含氧酸及盐,其中
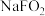 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子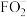 的价层电子对数为
的价层电子对数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】元素周期表是学习化学的工具,也为化学的进一步探索与研究提供了理论指导,化学学习者和研究者一直关注周期表的运用与发展。试回答下列问题:
(1)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是____________ (填写元素符号)。
(2)周期表第四周期中,未成对电子数最多的元素是______ ,它有 _____ 种运动状态不同的电子,属于 ______ 分区。
(3)元素周期表第一、二周期的四种元素氢、碳、氮、氧构成的分子中,键角最小的是____ 。
(4)人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式:________________________________ 。
(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如铍与铝处于对角线,请写出氢氧化铍和氢氧化钠溶液反应的离子方程式:________________ 。
(1)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是
(2)周期表第四周期中,未成对电子数最多的元素是
(3)元素周期表第一、二周期的四种元素氢、碳、氮、氧构成的分子中,键角最小的是
A、NH3 B、NF3 C、OF2 D、CF4
(4)人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式:
(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如铍与铝处于对角线,请写出氢氧化铍和氢氧化钠溶液反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)根据Mn原子的核外电子排布情况,回答下列问题:
①价层电子排布图为_______ 。
②在Mn原子的核外电子中,有_______ 种运动状态不同的电子,最高化合价为_______ 。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为_______ ,Sm的价层电子排布式4f66s2,Sm3+的价层电子排布式为_______ 。
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为_______ ,该能层具有的原子轨道数为_______ ,电子占据最高能级的电子云轮廓图为_______ 形。
②Li、B、H元素的电负性由大到小的排列顺序为_______ 。离子半径Li+_______ H-(填“>”“=”或“<”)。
(4)查表得知,元素X的电负性是1.5,元素Y的电负性是3.0,请判断X是_______ (填“金属”或“非金属”),元素X与元素Y形成的化合物属于_______ (填“离子化合物”或“共价化合物”),该化合物中显负价的是_______ (填“X”或“Y”)。
(1)根据Mn原子的核外电子排布情况,回答下列问题:
①价层电子排布图为
②在Mn原子的核外电子中,有
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为
②Li、B、H元素的电负性由大到小的排列顺序为
(4)查表得知,元素X的电负性是1.5,元素Y的电负性是3.0,请判断X是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知: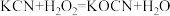 。回答下列问题:
。回答下列问题:
(1) 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为____________________ (用元素符号表示,下同),电负性从大到小的顺序为__________ ,基态氮原子最外层电子排布式为__________ 。
(2)与 互为等电子体的分子为
互为等电子体的分子为__________ (任举一例)。
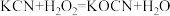 。回答下列问题:
。回答下列问题:(1)
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为(2)与
 互为等电子体的分子为
互为等电子体的分子为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】碳氢氟氮硅等非金属元素与人类的生产生活息息相关。回答下列问题:
(1)写出硅原子的电子排布式___________ 。C、Si、N的电负性由大到小的顺序是___________ 。
(2)氟化氢水溶液中存在氢键有___________ 种。
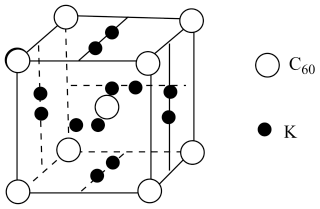
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为___________ 。
(4)继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:___________ 。
(1)写出硅原子的电子排布式
(2)氟化氢水溶液中存在氢键有
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为

(4)继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:
您最近一年使用:0次



