金属钛及其化合物被广泛应用于飞机、火箭、导弹、人造卫星、宇宙飞船、舰艇、军工、医疗以及石油化工等领域,人们称钛为“21世纪金属”。自然界中钛的一种存在形式为金红石(主要成分是TiO2)。回答下列问题:
(1)基态钛原子的价电子排布式为__________________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的元素分别是_________________ (填元素符号)。
(2)钛的硬度大于铝,其原因是_________________________ 。
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态TiCl4属于___________ 晶体。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是______ ,B原子的杂化轨道类型是___________ 。
(4)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体[TiCl(H2O)5]Cl2·H2O。该晶体所含元素中,电负性最大的元素是___________ ,与Ti形成配位键的配体是___________ ,1mol该配合物中含有σ键的数目为___________ 。
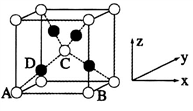
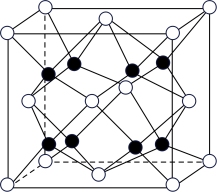
(5)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示(晶胞中相同位置的原子相同),其中A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,_____ ,______ ),钛氧键的键长d=___________ (用代数式表示)。

(1)基态钛原子的价电子排布式为
(2)钛的硬度大于铝,其原因是
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态TiCl4属于
②LiBH4由Li+和BH4-构成,BH4-的空间构型是
(4)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体[TiCl(H2O)5]Cl2·H2O。该晶体所含元素中,电负性最大的元素是
(5)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示(晶胞中相同位置的原子相同),其中A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,

更新时间:2019-03-06 11:07:21
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态价电子排布式为_______ ;
(2) 和
和 都是离子晶体,两种晶体熔点较低的是
都是离子晶体,两种晶体熔点较低的是_______ ,原因是_______ ;
(3)铜镍合金的立方晶胞结构如下图所示:

①原子B的分数坐标为_______ ;
②若该晶体密度为 ,以
,以 表示阿伏加德罗常数,则铜镍原子间最短距离为
表示阿伏加德罗常数,则铜镍原子间最短距离为_______ cm。
(1)铜原子基态价电子排布式为
(2)
 和
和 都是离子晶体,两种晶体熔点较低的是
都是离子晶体,两种晶体熔点较低的是(3)铜镍合金的立方晶胞结构如下图所示:

①原子B的分数坐标为
②若该晶体密度为
 ,以
,以 表示阿伏加德罗常数,则铜镍原子间最短距离为
表示阿伏加德罗常数,则铜镍原子间最短距离为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__ 族,其高价态离子核外有__ 个未成对电子。
(2)B、C、D三种元素的离子半径由小到大的顺序是______ (用离子符号表示)。
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______ 。
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是___________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为____________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________ ;该过程总的离子反应式为________________ 向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________ 。
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
(1)元素E在元素周期表中的位于第四周期第
(2)B、C、D三种元素的离子半径由小到大的顺序是
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Ti原子s轨道上总共有_______ 个电子,其价电子轨道表达式为____________ 。
(2)在基态N原子中,核外存在______ 对自旋相反的电子,核外电子占据的最高能层符号为______ ,占据该能层电子的电子云轮廓图形状为__________________ 。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法正确的是_____ 。
A. (N5)6(H3O)3(NH4)4Cl 中含四种离子 B. N5+N5-属于化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(4)BF3分子空间结构为___________ ;在NH3中N原子的杂化方式为_______ 。
(5)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是_______ ,配体是_________ 。
(6)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
请解释碱土金属元素碳酸盐热分解温度的变化规律:_______________________ 。
(7)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为_____ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。
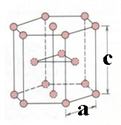
(1)基态Ti原子s轨道上总共有
(2)在基态N原子中,核外存在
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法正确的是
A. (N5)6(H3O)3(NH4)4Cl 中含四种离子 B. N5+N5-属于化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(4)BF3分子空间结构为
(5)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是
(6)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:
(7)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
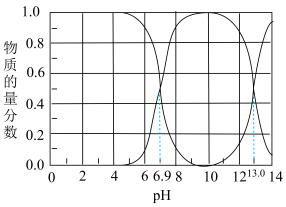
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
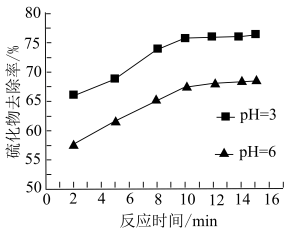
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
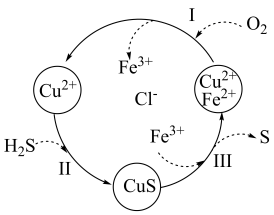
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
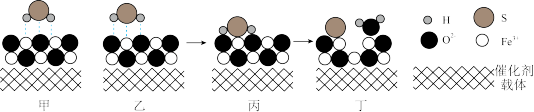
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为______ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点明显高于其他三种卤化物,TiCl4至TiI4熔点依次升高,原因是_______ 。
(3)CaTiO3组成元素的电负性最大的为______ (用元素符号表示)。
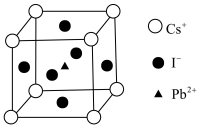
(4)某种金属卤化物无机钙钛矿的晶胞结构如图所示,晶胞的边长apm,则该物质的化学式为______ ;晶体的密度ρ=______ g•cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)。
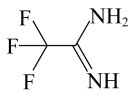
(5)我国科学家设计了一种钝化剂三氟乙脒(结构如图所示)来抑制上述金属卤化物钙钛矿晶粒表面缺陷,其中σ键与π键数目之比为______ ,两个碳原子的杂化类型分别为______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点明显高于其他三种卤化物,TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(4)某种金属卤化物无机钙钛矿的晶胞结构如图所示,晶胞的边长apm,则该物质的化学式为

(5)我国科学家设计了一种钝化剂三氟乙脒(结构如图所示)来抑制上述金属卤化物钙钛矿晶粒表面缺陷,其中σ键与π键数目之比为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Vilsmeier试剂是有机反应中的一种重要原料,由以下反应生成:
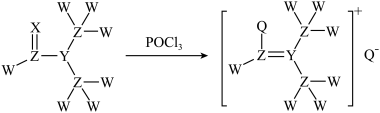
W、X、Y、Z、Q为短周期主族元素且三个短周期均有分布,五种元素中X的电负性最大,Y的单质在空气中含量最多,Z在自然界中形成的化合物种类最多,W元素的一种核素不含中子,该五种元素的原子在以上有机结构中均达到稳定结构,回答以下问题:
(1)写出各元素的元素符号:W___________ ;X___________ ;Y___________ ;Z___________ ;Q___________ 。
(2)基态Y原子的核外价层电子排布图为___________ ;基态X原子中未成对电子数为___________ 。
(3)基态X、Y、Z原子的第一电离能从大到小的排序为___________ (用元素符号表示),理由是___________ 。
(4)下列说法正确的是___________。
(5)实验室用Cu和HNO3制备化合物YX的化学方程式为___________ 。

W、X、Y、Z、Q为短周期主族元素且三个短周期均有分布,五种元素中X的电负性最大,Y的单质在空气中含量最多,Z在自然界中形成的化合物种类最多,W元素的一种核素不含中子,该五种元素的原子在以上有机结构中均达到稳定结构,回答以下问题:
(1)写出各元素的元素符号:W
(2)基态Y原子的核外价层电子排布图为
(3)基态X、Y、Z原子的第一电离能从大到小的排序为
(4)下列说法正确的是___________。
| A.电负性:Y<Z | B.Q2X中,X为 价 价 |
| C.基态Q原子有17种能量不同的电子 | D.W、Y、Q三种元素可以组成离子化合物 |
(5)实验室用Cu和HNO3制备化合物YX的化学方程式为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】化合物H是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
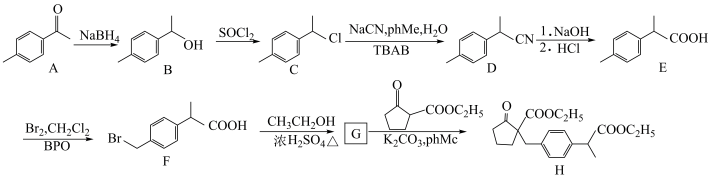
(1)A的分子式________ ﹔B→C的反应类型________ 。
(2)B的含氧官能团名称________ ;D中氮(N)的杂化方式_______ 。
(3)G的结构简式_______ 。
(4)F→G反应中乙醇可能发生的副反应方程式_______ 。
(5)F的一种同分异构体同时满足下列条件,写出任意一种该同分异构体的结构简式_______ 。
①分子中含有苯环;
②不能与Na2CO3反应生成CO2;
③含有手性碳原子。

(1)A的分子式
(2)B的含氧官能团名称
(3)G的结构简式
(4)F→G反应中乙醇可能发生的副反应方程式
(5)F的一种同分异构体同时满足下列条件,写出任意一种该同分异构体的结构简式
①分子中含有苯环;
②不能与Na2CO3反应生成CO2;
③含有手性碳原子。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硼、铝元素位于金属分界线附近,其化合物性质相对复杂。
(1)硼在元素周期表中的位置是___________ 。铍、硼、铝的第一电离能从大到小依次是___________ 。
(2) 分子的空间形状为
分子的空间形状为___________ ,B原子的杂化形式为___________ 。
(3) 可与
可与 溶液反应得到
溶液反应得到 溶液。结晶可得
溶液。结晶可得 晶体,其熔点为
晶体,其熔点为 ,由
,由 构成。
构成。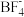 的结构式为
的结构式为___________ 。(已知: 的结构式为
的结构式为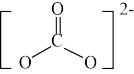 )
)
(4)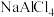 的晶体结构与
的晶体结构与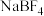 相似,其熔点为
相似,其熔点为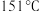 。请解释其熔点小于
。请解释其熔点小于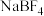 的原因:原子半径:
的原因:原子半径: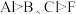 ,
,___________ 。
(5)研究表明:NaAlCl4化学性质较为稳定,加热至 以上才开始分解,得到
以上才开始分解,得到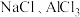 。而
。而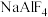 在
在 即开始分解,释放出
即开始分解,释放出 。已知:
。已知:
ⅰ.这两种物质的稳定性主要与阴离子的配位键强弱有关,其他因素影响较小;
ⅱ.配位键键能与中心原子接受电子的能力、配位原子给出电子的能力有关。
请从原子结构角度解释两种物质的稳定性差异:两种物质的阴离子中心原子相同,配位原子不同;F与 原子最外层电子数相同,电子层数:
原子最外层电子数相同,电子层数: ,原子半径:
,原子半径: ,
,___________ ,稳定性: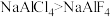 。
。
(1)硼在元素周期表中的位置是
(2)
 分子的空间形状为
分子的空间形状为(3)
 可与
可与 溶液反应得到
溶液反应得到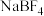 溶液。结晶可得
溶液。结晶可得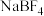 晶体,其熔点为
晶体,其熔点为 ,由
,由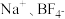 构成。
构成。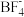 的结构式为
的结构式为 的结构式为
的结构式为 )
)(4)
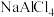 的晶体结构与
的晶体结构与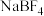 相似,其熔点为
相似,其熔点为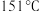 。请解释其熔点小于
。请解释其熔点小于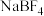 的原因:原子半径:
的原因:原子半径: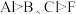 ,
,(5)研究表明:NaAlCl4化学性质较为稳定,加热至
 以上才开始分解,得到
以上才开始分解,得到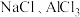 。而
。而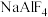 在
在 即开始分解,释放出
即开始分解,释放出 。已知:
。已知:ⅰ.这两种物质的稳定性主要与阴离子的配位键强弱有关,其他因素影响较小;
ⅱ.配位键键能与中心原子接受电子的能力、配位原子给出电子的能力有关。
请从原子结构角度解释两种物质的稳定性差异:两种物质的阴离子中心原子相同,配位原子不同;F与
 原子最外层电子数相同,电子层数:
原子最外层电子数相同,电子层数: ,原子半径:
,原子半径: ,
,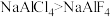 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】过渡元素中,Ti被誉为“未来金属”、“战略金属”,其具有稳定的化学性质。回答下列问题:
(1)基态钛原子的电子排布式为_______ 。
(2)Ti可形成多种配合物。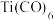 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是_______ (写元素符号);CO作配体时,配位原子是C而不是O,其原因是_______ ; 中
中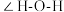
_______ (填“大于”、“小于”或“等于”)单个水分子中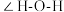 。
。
(3) 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是_______ ,其中Ti原子采取_______ 杂化。
(4)如图为四方晶系的 晶体结构:
晶体结构:
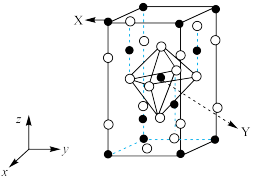
●表示_______ 原子(填元素符号),晶胞参数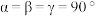 ,底面边长为
,底面边长为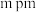 ,高为
,高为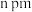 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为_______ pm(列出计算式)。
(1)基态钛原子的电子排布式为
(2)Ti可形成多种配合物。
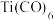 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是 中
中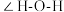
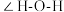 。
。(3)
 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是(4)如图为四方晶系的
 晶体结构:
晶体结构:
●表示
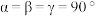 ,底面边长为
,底面边长为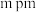 ,高为
,高为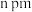 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为__________ ,S、O、N三种元素的第一电离能由大到小的顺序为___________________ 。
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为________ ,[Cu(NH3)4](NO3)2中存在的化学键除了极性共价键外,还有___________ 。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN‑中含有的π键数目为_____________ 。与CN-互为等电子体的离子有_________ (写出一种即可)。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是_______________________________ 。
(5)已知Cu2O晶胞结构如图所示:该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);c为 。则D原子的坐标参数为
。则D原子的坐标参数为__________ ,它代表_________ 原子(填元素符号)。
(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是_______ ,该晶胞中Cu原子的空间利用率是__________ 。
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN‑中含有的π键数目为
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是

(5)已知Cu2O晶胞结构如图所示:该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);c为
 。则D原子的坐标参数为
。则D原子的坐标参数为(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 、
、 、
、 元素的化合物)和黄铁矿
元素的化合物)和黄铁矿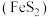 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知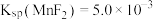 、
、
(1)“酸浸”时,所用的稀酸 是
是_______ 。
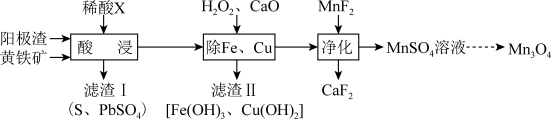
(2)“酸浸”过程中,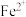 、
、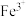 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。
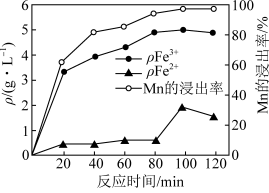
①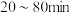 内,浸出Mn元素的主要离子方程式为
内,浸出Mn元素的主要离子方程式为_______ 。
②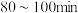 时,
时,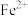 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)若“净化”过程中 的浓度为
的浓度为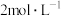 ,则此时
,则此时 的浓度为
的浓度为_______  。
。
(4) 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向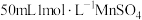 溶液中缓慢滴加
溶液中缓慢滴加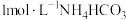 ,则加入
,则加入 溶液的体积至少为
溶液的体积至少为_______  。
。

(5) 的晶胞结构如图所示,每个
的晶胞结构如图所示,每个 周围最近且相等的
周围最近且相等的 在空间构成的形状为
在空间构成的形状为_______ 。
 ,杂质为
,杂质为 、
、 、
、 元素的化合物)和黄铁矿
元素的化合物)和黄铁矿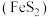 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知
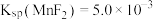 、
、
(1)“酸浸”时,所用的稀酸
 是
是(2)“酸浸”过程中,
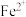 、
、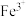 的质量浓度、Mn浸出率与时间的关系如图所示。
的质量浓度、Mn浸出率与时间的关系如图所示。
①
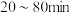 内,浸出Mn元素的主要离子方程式为
内,浸出Mn元素的主要离子方程式为②
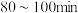 时,
时,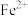 浓度上升的原因可能是
浓度上升的原因可能是(3)若“净化”过程中
 的浓度为
的浓度为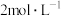 ,则此时
,则此时 的浓度为
的浓度为 。
。(4)
 制取
制取 的一种流程如图,在搅拌下向
的一种流程如图,在搅拌下向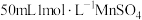 溶液中缓慢滴加
溶液中缓慢滴加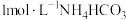 ,则加入
,则加入 溶液的体积至少为
溶液的体积至少为 。
。
(5)
 的晶胞结构如图所示,每个
的晶胞结构如图所示,每个 周围最近且相等的
周围最近且相等的 在空间构成的形状为
在空间构成的形状为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铬、锰、铁、钴、镍等过渡金属元素的单质及其化合物在工农业、国防、科技等领域具有广泛应用。
(1)基态Cr原子中有_________ 个未成对电子,最外层电子所占用能级的电子云形状为_______ 。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1〜d9排布时,有颜色。则:[Mn(H2O)6]2+________ (填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示
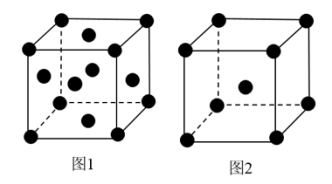
①图1和图2中Fe原子的配位数分别为_______________ 和________________ 。
②若图2的晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________ pm。(用含ρ、NA的代数式表示)
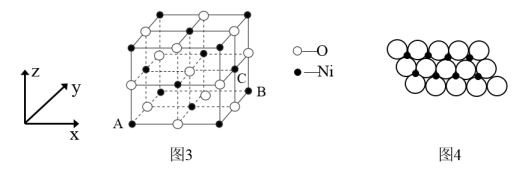
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________ NiO(填“>”“<”或“=”),理由是_______________ 。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________ 。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________ g。(用含ɑ、NA的代数式表示)
(1)基态Cr原子中有
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1〜d9排布时,有颜色。则:[Mn(H2O)6]2+
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为
②若图2的晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为

您最近一年使用:0次



