铬、锰、铁、钴、镍等过渡金属元素的单质及其化合物在工农业、国防、科技等领域具有广泛应用。
(1)基态Cr原子中有_________ 个未成对电子,最外层电子所占用能级的电子云形状为_______ 。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1〜d9排布时,有颜色。则:[Mn(H2O)6]2+________ (填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示
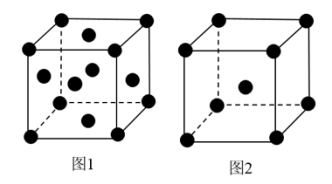
①图1和图2中Fe原子的配位数分别为_______________ 和________________ 。
②若图2的晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________ pm。(用含ρ、NA的代数式表示)
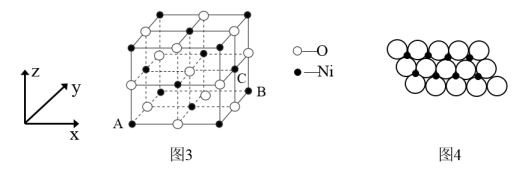
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________ NiO(填“>”“<”或“=”),理由是_______________ 。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________ 。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________ g。(用含ɑ、NA的代数式表示)
(1)基态Cr原子中有
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1〜d9排布时,有颜色。则:[Mn(H2O)6]2+
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为
②若图2的晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为

2017·湖南长沙·一模 查看更多[4]
湖南省长沙市长郡中学2017届高三高考模拟卷二理综化学试题2020高考化学二轮总复习高分必备 题型专题2 非选择题专练(已下线)2021年高考化学押题预测卷(湖南卷)02(含考试版、答题卡、参考答案、全解全析)内蒙古自治区科尔沁左翼中旗实验高级中学2023-2024学年高三上学期11月月考化学试题
更新时间:2017-06-03 16:31:51
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】铁及其化合物有着极其广泛的用途。回答下列问题:
(1)基态铁原子的核外电子中有________ 对成对电子。
(2)基态铁原子的五级电离能数据如图1所示,其中 到
到 的电离能差值较大,其主要原因是
的电离能差值较大,其主要原因是____________ 。

(3)甘氨酸亚铁是一种具有口服活性的铁强化剂和补充剂。其制备反应如下:

甘氨酸亚铁分子中Fe2+的配体的化学式是__________ ,分子中碳原子的杂化类型是__________ 。
(4)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是____________ 。
(5)磁性氮化铁的晶胞结构如图2所示,沿z轴方向的投影如图3所示,则该化合物的化学式为____________ 。

(1)基态铁原子的核外电子中有
(2)基态铁原子的五级电离能数据如图1所示,其中
 到
到 的电离能差值较大,其主要原因是
的电离能差值较大,其主要原因是
(3)甘氨酸亚铁是一种具有口服活性的铁强化剂和补充剂。其制备反应如下:

甘氨酸亚铁分子中Fe2+的配体的化学式是
(4)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是
(5)磁性氮化铁的晶胞结构如图2所示,沿z轴方向的投影如图3所示,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。回答下列问题:
(1)基态钪(Se)原子核外电子排布式为_______ ,M能层中能量不同的电子有_______ 种。
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是_______ (填“微粒符号”)。
(3)Sm(钐)的单质与1,2-二碘乙烧可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为_______ ,1molCH2=CH2中含有的σ键数目为_______ 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是_______ 。
(4)化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显+4价。下面四种稀土元素的电离能(单位:kJ·mol-1)数据如下表,判断最有可能显+4价的稀土元素是________ (填元素符号)。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,则PrO2(二氧化镨)的晶胞中Pr原子的配位数为_______ 。原子与Pr原子配位数不同,影响这一结果的是离子晶体的_______ (填“几何”“电荷”或“键性”)因素。
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为_______ 。

(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示。当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为___ cm。
(1)基态钪(Se)原子核外电子排布式为
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是
(3)Sm(钐)的单质与1,2-二碘乙烧可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为
(4)化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显+4价。下面四种稀土元素的电离能(单位:kJ·mol-1)数据如下表,判断最有可能显+4价的稀土元素是
| 元素 | I1 | I2 | I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 7019 |
| Y(铱) | 616 | 1181 | 1980 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为

(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示。当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
元素M化合态常见化合价是_________ 价,其基态原子电子排布式为_________ 。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________ 。
(3)PO43-的中心原子的杂化方式为_________ ,该离子的空间构型为_________ ,键角为________ ,其等电子体有_________ (请写出两种)。
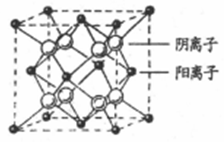
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________ ;已知Ca2+和F−半径分别为a cm、b cm,阿伏伽德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm−3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________ ,原因为___________ 。
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为
(3)PO43-的中心原子的杂化方式为
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
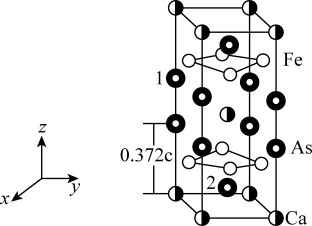
【推荐1】最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为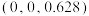 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
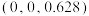 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】明代宋应星《天工开物·铜》写道:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的轨道表示式:___ 。
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式_____ ,[Cu(NH3)4]SO4·H2O中与Cu2+形成配位键的原子是___ (填元素符号),若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行___ 实验。
(3)含有钠元素的盐的焰色反应为____ 色,许多金属盐都可以发生焰色反应,其原因是____ 。
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。
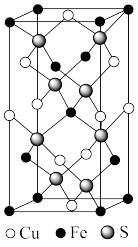
①Cu+的配位数为_______ ,
②已知:底边a=b=0.524nm,高c=1.032nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是____ g•cm-3(列出计算表达式即可)。
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的轨道表示式:
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式
(3)含有钠元素的盐的焰色反应为
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。

①Cu+的配位数为
②已知:底边a=b=0.524nm,高c=1.032nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
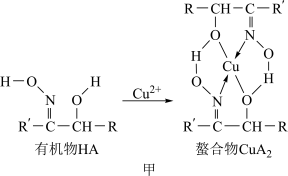
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数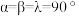 ,
, ,
,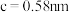 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
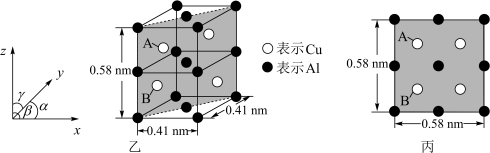
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
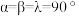 ,
, ,
,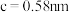 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铈[外围电子排布(n-2)f1(n-1)d1ns2]是原子序数为58的一种最早有实际用途的稀土元素,铈及其化合物的用途十分广泛。
(1)硝酸铈铵Ce(NH4)2(NO3)6中,N的杂化方式为___ ;Ce、C、N、O的第一电离能由大到小的顺序为___ 。
(2)已知CeX3的熔点为CeF3:1460℃、CeCl3:848℃、CeBr3:732℃、CeI3:760℃,依F、Cl、Br、I顺序,从CeX3中化学键的离子性和共价性说明熔点的变化原因__ 。
(3)铈的一种氧化物具有独特的晶体结构和较高的储存和释放氧的能力,可形成氧空位具有催化氧化性能,有着十分广阔的应用开发前景,其晶体结构如图所示:

①这种铈的氧化物的化学式为__ ;晶胞中氧离子的配位数为__ 。
②若该铈的氧化物的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则最近的两个氧离子之间的距离为__ nm。(用ρ、NA表示,不必化简)
③计算六个面心铈离子与图中虚线立方体中的八个氧离子组成的二十四面体体积__ cm3。
(1)硝酸铈铵Ce(NH4)2(NO3)6中,N的杂化方式为
(2)已知CeX3的熔点为CeF3:1460℃、CeCl3:848℃、CeBr3:732℃、CeI3:760℃,依F、Cl、Br、I顺序,从CeX3中化学键的离子性和共价性说明熔点的变化原因
(3)铈的一种氧化物具有独特的晶体结构和较高的储存和释放氧的能力,可形成氧空位具有催化氧化性能,有着十分广阔的应用开发前景,其晶体结构如图所示:

①这种铈的氧化物的化学式为
②若该铈的氧化物的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则最近的两个氧离子之间的距离为
③计算六个面心铈离子与图中虚线立方体中的八个氧离子组成的二十四面体体积
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铁、钛、镍等过渡元素在工业生产和科学研究中具有重要作用,请回答下列问题。
(1)有机铁肥 的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子
的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子 的价电子排布图为
的价电子排布图为__________ ;它所含非金属元素原子 除
除 外
外 的第一电离能
的第一电离能 由小到大的顺序是
由小到大的顺序是________________ 。
(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
 钛在元素周期表中的位置是
钛在元素周期表中的位置是___________ 。
 工业上可用
工业上可用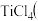 常温下呈液态
常温下呈液态 与
与 高温下反应制备钛单质,同时生成
高温下反应制备钛单质,同时生成 ,详细解释
,详细解释 熔点比
熔点比 低很多的原因
低很多的原因_______________________ 。
(3)镍钛记忆合金用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如下图所示,其中 原子采用面心立方最密堆积方式,该合金中与
原子采用面心立方最密堆积方式,该合金中与 原子距离最近且相等的
原子距离最近且相等的 原子个数为
原子个数为________ ;若合金的密度为 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是________ 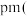 用含
用含 和
和 的计算式表示,不必化简
的计算式表示,不必化简 。
。

(1)有机铁肥
 的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子
的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子 的价电子排布图为
的价电子排布图为 除
除 外
外 的第一电离能
的第一电离能 由小到大的顺序是
由小到大的顺序是(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
 钛在元素周期表中的位置是
钛在元素周期表中的位置是 工业上可用
工业上可用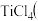 常温下呈液态
常温下呈液态 与
与 高温下反应制备钛单质,同时生成
高温下反应制备钛单质,同时生成 ,详细解释
,详细解释 熔点比
熔点比 低很多的原因
低很多的原因(3)镍钛记忆合金用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如下图所示,其中
 原子采用面心立方最密堆积方式,该合金中与
原子采用面心立方最密堆积方式,该合金中与 原子距离最近且相等的
原子距离最近且相等的 原子个数为
原子个数为 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是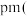 用含
用含 和
和 的计算式表示,不必化简
的计算式表示,不必化简 。
。 
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面。A、B两种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是___________ (填字母)。
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:______ ,E原子的配位数为:_______ 。

(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式__________________________ ,___________________ 。
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是______ 、______ 。两者沸点的关系为X___ Y(>,或<),原因是_____________________________________________________ 。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:

(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是
您最近一年使用:0次



