Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
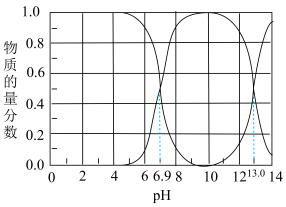
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
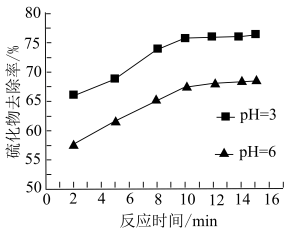
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
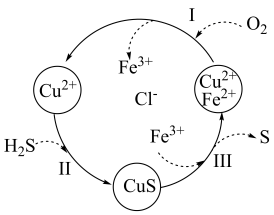
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
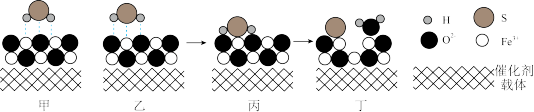
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
更新时间:2023-11-14 14:18:20
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】KMnO4是一种常用的氧化剂。某实验小组利用氯气氧化K2MnO4制备KMnO4并对其性质进行探究。
资料:①锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-
+MnO2↓+4OH-
②酸性条件下的氧化性:KMnO4>KIO3>I2
I.KMnO4的制备
(1)从A~D中选择合适的装置制备KMnO4,正确的连接顺序是a→______________ (按气流方向,用小写字母表示);装置A中m的作用是_______ 。

(2)若没有使用装置C,造成的影响是_______ 。
II.KMnO4性质探究
取适量制取的KMnO4溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的KMnO4溶液2mL于试管中,逐滴滴加0.1mol/LKI溶液,KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
(3)最终溶液呈现棕黄色推测生成了_______ (写化学式)。
(4)实验小组对初始阶段的产物成分进行探究:

①黑色固体是MnO2,试剂X是_______ (写化学式)。
②在“紫色清液"中存在 ,写出生成
,写出生成 的离子方程式
的离子方程式_______ 。
③下列实验方案中,可用于检验“紫色清液"中是否存在 的是
的是_______ (填序号)。
A.用洁净的玻璃棒随取紫色清液滴在淀粉-KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(5)探究实验II中棕褐色沉淀消失的原因:

用离子方程式解释步骤③中固体消失的原因_______ 。
(6)由上述实验可知,KMnO4的还原产物与_______ 有关。
资料:①锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-
+MnO2↓+4OH-②酸性条件下的氧化性:KMnO4>KIO3>I2
I.KMnO4的制备
(1)从A~D中选择合适的装置制备KMnO4,正确的连接顺序是a→

(2)若没有使用装置C,造成的影响是
II.KMnO4性质探究
取适量制取的KMnO4溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的KMnO4溶液2mL于试管中,逐滴滴加0.1mol/LKI溶液,KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
(3)最终溶液呈现棕黄色推测生成了
(4)实验小组对初始阶段的产物成分进行探究:

①黑色固体是MnO2,试剂X是
②在“紫色清液"中存在
 ,写出生成
,写出生成 的离子方程式
的离子方程式③下列实验方案中,可用于检验“紫色清液"中是否存在
 的是
的是A.用洁净的玻璃棒随取紫色清液滴在淀粉-KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(5)探究实验II中棕褐色沉淀消失的原因:

用离子方程式解释步骤③中固体消失的原因
(6)由上述实验可知,KMnO4的还原产物与
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被
可被 还原为
还原为 。
。
iii. 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
(1)B中试剂是___________ 。
(2)通入 前,II、III中沉淀由白色
前,II、III中沉淀由白色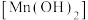 变为棕黑色,补全发生反应的化学方程式:
变为棕黑色,补全发生反应的化学方程式:___________ 。

(3)对比实验I、II通入 后的实验现象,对于二价锰化合物还原性的认识是:
后的实验现象,对于二价锰化合物还原性的认识是:
①___________ ;
②在碱性条件下二价锰可以被氧化到更高价态。
(4)根据资料ii,II中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
IV中溶液紫色迅速变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是 被
被___________ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③分析IV、V实验现象不同的原因是___________ 。
资料:i.
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被
可被 还原为
还原为 。
。iii.
 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)

| 序号 | I | II | III |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
通入 前C中实验现象 前C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
通入 后C中实验现象 后C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)B中试剂是
(2)通入
 前,II、III中沉淀由白色
前,II、III中沉淀由白色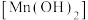 变为棕黑色,补全发生反应的化学方程式:
变为棕黑色,补全发生反应的化学方程式:
(3)对比实验I、II通入
 后的实验现象,对于二价锰化合物还原性的认识是:
后的实验现象,对于二价锰化合物还原性的认识是:①
②在碱性条件下二价锰可以被氧化到更高价态。
(4)根据资料ii,II中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | IV | V |
| 操作 | 取III中放置后的1mL悬浊液,加入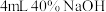 溶液 溶液 | 取III中放置后的1mL悬浊液,加入4mL水 |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 被
被③分析IV、V实验现象不同的原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
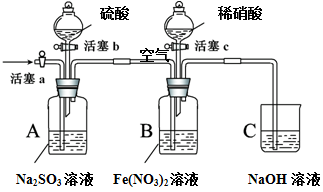
实验记录如下:
请回答下列问题:
(1)实验I中,发生反应的离子方程式是_________________________________ 。
(2)实验IV的后续操作是___________________ ,观察到的现象是___________ 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是__________________ 。
(4) 实验操作V的目的是_______________________ 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是____________________________ 。

实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色。 |
| II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
| III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
| V | 打开活塞a,通入一段时间空气 | ———— |
(1)实验I中,发生反应的离子方程式是
(2)实验IV的后续操作是
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是
(4) 实验操作V的目的是
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】矿产资源是重要的自然资源,不可再生,回收、再生是保护金属矿产资源的有效途径。
Ⅰ.稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是从钛尾矿回收、制备Sc的工艺流程。

已知:①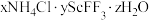 是
是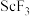 与氯化物形成的复盐沉淀,在强酸中部分溶解。
与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)钪原子的外围电子排布式为_______ 。
(2)焙烧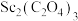 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为_______ 。
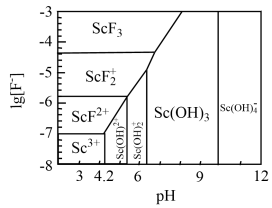
(3)如图是含Sc元素的离子与 浓度和pH的关系。用氨水调节溶液pH,控制在
浓度和pH的关系。用氨水调节溶液pH,控制在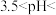
_______ 范围内。
(4)传统制备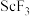 的方法是先得到
的方法是先得到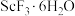 沉淀,再高温脱水得
沉淀,再高温脱水得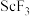 ,但通常含有
,但通常含有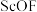 杂质,原因是
杂质,原因是_______ (用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的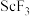 ,其原因是
,其原因是_______ 。
Ⅱ.某化学兴趣小组欲模拟化工生产工艺,回收某油脂厂废弃的油脂加氢镍催化剂(主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质)中的镍并制备硫酸镍(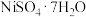 )。
)。
已知:①镍在稀酸中可缓慢溶解,耐强碱。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(5)该兴趣小组设计了如下模拟实验方案:取一定量废镍催化剂粉末于烧杯中,在不断搅拌下加入NaOH溶液(碱浸),充分反应并过滤,取滤出物于烧杯中,加入_______ (填试剂名称),充分搅拌,过滤,向滤液中加适量 溶液,充分反应,再加入NaOH溶液,调节
溶液,充分反应,再加入NaOH溶液,调节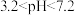 ,过滤、
,过滤、_______ 、_______ (填操作)、过滤、洗涤、干燥得到硫酸镍晶体。
Ⅰ.稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是从钛尾矿回收、制备Sc的工艺流程。

已知:①
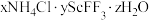 是
是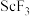 与氯化物形成的复盐沉淀,在强酸中部分溶解。
与氯化物形成的复盐沉淀,在强酸中部分溶解。②“脱水除铵”是复盐沉淀的热分解过程。

据此回答:
(1)钪原子的外围电子排布式为
(2)焙烧
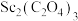 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为(3)如图是含Sc元素的离子与
 浓度和pH的关系。用氨水调节溶液pH,控制在
浓度和pH的关系。用氨水调节溶液pH,控制在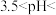
(4)传统制备
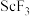 的方法是先得到
的方法是先得到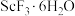 沉淀,再高温脱水得
沉淀,再高温脱水得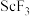 ,但通常含有
,但通常含有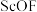 杂质,原因是
杂质,原因是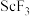 ,其原因是
,其原因是Ⅱ.某化学兴趣小组欲模拟化工生产工艺,回收某油脂厂废弃的油脂加氢镍催化剂(主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质)中的镍并制备硫酸镍(
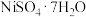 )。
)。已知:①镍在稀酸中可缓慢溶解,耐强碱。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
 溶液,充分反应,再加入NaOH溶液,调节
溶液,充分反应,再加入NaOH溶液,调节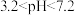 ,过滤、
,过滤、
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),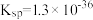
(1)装置A中发生的化学反应方程式是_______ 。
(2)加入药品前,检验装置气密性,方法是_______ 。
(3)装置B的作用是_______ 。
(4)实验Ⅲ中生成黑色沉淀的离子方程式是_______ 。
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离_______ 。
②完善下列离子方程式:_______ 。
_______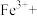 _______
_______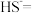 _______
_______ _______
_______ _______。
_______。
结论:实验Ⅱ的pH比实验Ⅰ的小, 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。
(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是_______ 。
(7)实验Ⅰ充分反应后,测 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为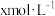 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中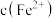 还需要的实验数据:
还需要的实验数据:___ 。
 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),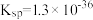
| 序号 | 溶液N | C中实验现象 |
| Ⅰ | 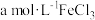 溶液( 溶液(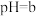 ) ) | 溶液颜色变浅,有乳白色沉淀生成 |
| Ⅱ | 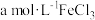 溶液(含少量稀 溶液(含少量稀 , ,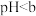 ) ) | 溶液颜色变浅,有乳白色沉淀生成,沉淀比实验Ⅰ少 |
| Ⅲ | 一定浓度的 溶液 溶液 | 溶液颜色变浅,有黑色沉淀生成 |
| Ⅳ | 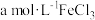 (含有一定浓度的 (含有一定浓度的 溶液, 溶液,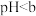 ) ) | 溶液颜色变浅,先有黑色沉淀生成,一段时间后转化为乳白色,沉淀比实验Ⅰ多 |
(1)装置A中发生的化学反应方程式是
(2)加入药品前,检验装置气密性,方法是
(3)装置B的作用是
(4)实验Ⅲ中生成黑色沉淀的离子方程式是
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离②完善下列离子方程式:
_______
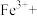 _______
_______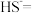 _______
_______ _______
_______ _______。
_______。结论:实验Ⅱ的pH比实验Ⅰ的小,
 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是
(7)实验Ⅰ充分反应后,测
 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为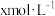 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中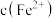 还需要的实验数据:
还需要的实验数据:
您最近一年使用:0次
【推荐3】方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
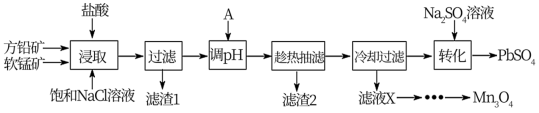
已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌ (aq) ΔH>0
(aq) ΔH>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
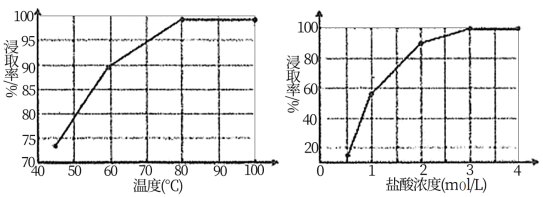
(1)根据图象分析,“浸取”过程反应的最佳条件是_______ 。
(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是_______ 。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为_______ 。
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是__ (填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
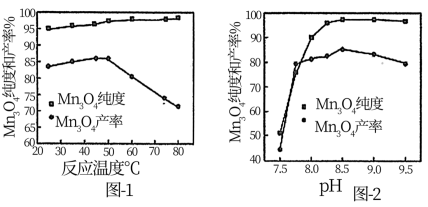
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:_______ ,真空干燥4小时得产品Mn3O4.(实验中须使用的试剂:氨水、空气)

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌
 (aq) ΔH>0
(aq) ΔH>0③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
(1)根据图象分析,“浸取”过程反应的最佳条件是

(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是
A.MnCO3 B.NaOH C.ZnO D.PbO
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:

您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】有机物K合成路线如下图 (部分条件已省略)。

已知:
①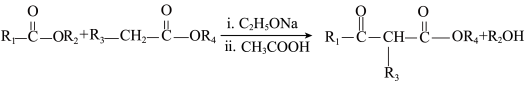
②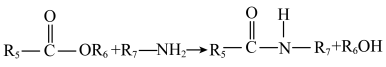 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
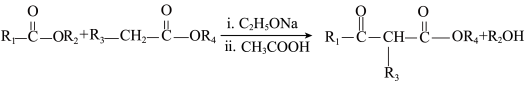
②
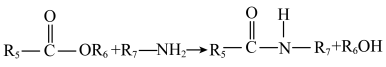 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近一年使用:0次
【推荐2】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______ ,电子占据最高能级上的电子数为______ 。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________ 。
②1molCO2中含有的σ键数目为________ ,其中C原子的杂化方式为_________ ;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________ 。
③Na2O的熔点比NaF的高,其理由是:_________ 。
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________ (填微粒符号)。

(4)冰晶石稀溶液中存在的化学键有________ (填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______ pm。
(1)基态氟原子中,电子占据的最高能层的符号为
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为
②1molCO2中含有的σ键数目为
③Na2O的熔点比NaF的高,其理由是:
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是

(4)冰晶石稀溶液中存在的化学键有
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】第III A主族元素有着广泛的应用,B可用作特种玻璃,Al可用作火箭和飞机外壳,Ga可用作半导体材料,In可用于电子仪器中,Tl可用于红外技术。回答下列问题:
(1)基态Ga原子的电子排布式为_______ ,有_______ 种不同运动状态的电子。
(2)B能形成很多类似于烃类的物质,比如B2H6,分子中B也形成四根键,但不含B-B键,试画出B2H6的结构式_______ 。此外B与N元素可形成无机苯B3N3H6,它与苯的结构很相似,该分子中N的杂化方式是_______ 。
(3)电解氧化铝需要添加冰晶石Na3AlF6,它的阴离子的空间结构为_______ ,它可通过以下反应制备:Al(OH)3 + 3NaOH + 6HF = Na3AlF6 + 6H2O,该反应涉及的5种元素电负性最大的是_______ 。
(4)AlF3,AlCl3熔点分别为1290 oC和192 oC,熔点呈现如此变化的原因是_______ 。
(5)H3BO3晶体形成层状结构,每一层的结构如下图所示,层与层之间距离为318 pm(大于氢键的长度),硼酸晶体属于_______ 晶体,晶体中含有的作用力有_______ ,在一层硼酸晶体结构中最小的重复单元含有_______ 个H3BO3分子。

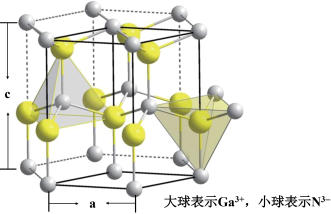
(6)GaN是二元Ⅲ-Ⅴ A族的直接带隙半导体,非常适合制造光电器件,GaN具有六方纤锌矿结构,晶胞示意图如下图所示,该晶胞的边长a = 318 pm,c = 517 pm。该GaN晶体的密度ρ =_______ g·cm-3。(只列计算式,NA表示阿伏加德罗常数)
(1)基态Ga原子的电子排布式为
(2)B能形成很多类似于烃类的物质,比如B2H6,分子中B也形成四根键,但不含B-B键,试画出B2H6的结构式
(3)电解氧化铝需要添加冰晶石Na3AlF6,它的阴离子的空间结构为
(4)AlF3,AlCl3熔点分别为1290 oC和192 oC,熔点呈现如此变化的原因是
(5)H3BO3晶体形成层状结构,每一层的结构如下图所示,层与层之间距离为318 pm(大于氢键的长度),硼酸晶体属于

(6)GaN是二元Ⅲ-Ⅴ A族的直接带隙半导体,非常适合制造光电器件,GaN具有六方纤锌矿结构,晶胞示意图如下图所示,该晶胞的边长a = 318 pm,c = 517 pm。该GaN晶体的密度ρ =

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________ ,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
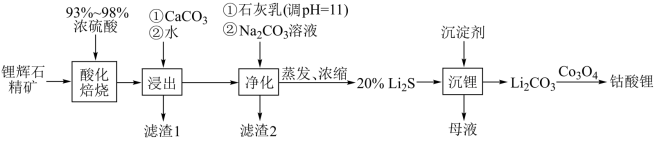
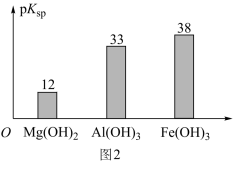
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________ 。
②为提高“酸化焙烧”效率,常采取的措施是________ 。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ 。(已知:完全沉淀后离子浓度低于1×l0-5) mol/L)
④“滤渣2”的主要化学成分为_______ 。
⑤“沉锂”过程中加入的沉淀剂为饱和的__________ (化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“ ___________ ”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________ 。
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 LixC6+Li1-xCoO2其工作原理如图2。
LixC6+Li1-xCoO2其工作原理如图2。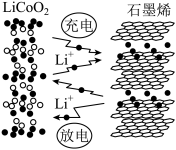
下列关于该电池的说法正确的是___________ (填字母)。
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为
②为提高“酸化焙烧”效率,常采取的措施是
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
④“滤渣2”的主要化学成分为
⑤“沉锂”过程中加入的沉淀剂为饱和的
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6
 LixC6+Li1-xCoO2其工作原理如图2。
LixC6+Li1-xCoO2其工作原理如图2。
下列关于该电池的说法正确的是
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:

请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____ 。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________ 。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________ ;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________ 。

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________ 。
(5) “脱锑”时发生的主要化学反应属于_________ 。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________ ;镀锡时阳极反应式为______________ 。

请回答下列问题:
(1) Sb(ⅤA)最高正化合价为
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为
(5) “脱锑”时发生的主要化学反应属于
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】连二硫酸锰(MnS2O6)常用于灭菌以及水果、蔬菜的保鲜。硫酸锰(MnSO4)是重要的微量元素肥料之一,也用作饲料添加剂,在涂料、造纸、陶瓷、电子、纺织等领域也有广泛应用。利用MnO2悬浊液吸收SO2气体制取MnS2 O6和MnSO4的装置如图所示(部分夹持仪器、加热仪器未画出)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为___________ ,该仪器中装入的试剂最好为___________ (填标号)。
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置___________ (填标号)中生成,装置B的作用为___________ 。
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为___________ 。
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是___________ 。
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。___________ 。(填标号)
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
③产品中锰的质量分数是___________ (列出计算式)。
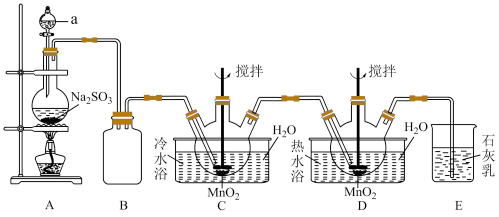
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将
③产品中锰的质量分数是
您最近一年使用:0次



