方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
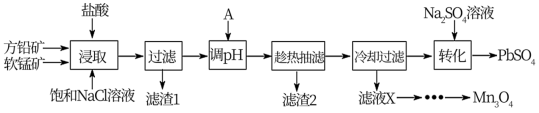
已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌ (aq) ΔH>0
(aq) ΔH>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
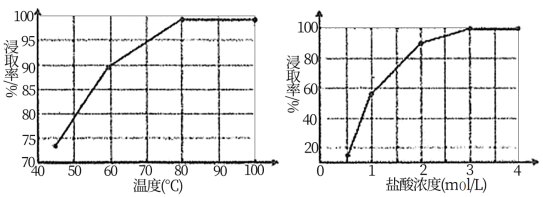
(1)根据图象分析,“浸取”过程反应的最佳条件是_______ 。
(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是_______ 。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为_______ 。
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是__ (填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
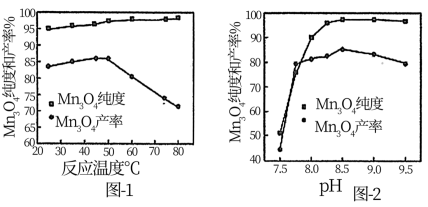
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:_______ ,真空干燥4小时得产品Mn3O4.(实验中须使用的试剂:氨水、空气)

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌
 (aq) ΔH>0
(aq) ΔH>0③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
(1)根据图象分析,“浸取”过程反应的最佳条件是

(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是
A.MnCO3 B.NaOH C.ZnO D.PbO
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:

更新时间:2021-03-07 20:38:21
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
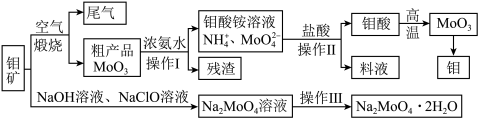
【推荐1】过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
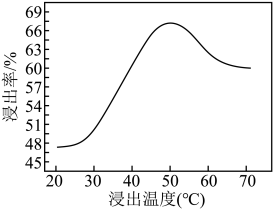
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】过硫酸钠(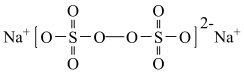 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
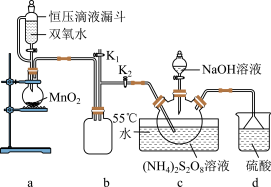
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。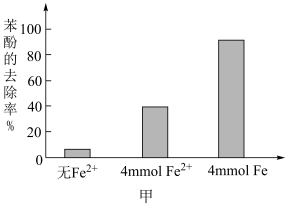
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
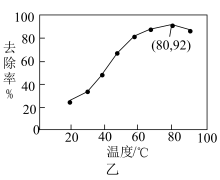
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为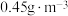 ,
,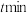 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: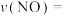
 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的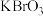 固体配制100mL的a
固体配制100mL的a 
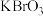 标准溶液;
标准溶液;
Ⅱ.取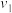 mL上述溶液,加入过量KBr,加
mL上述溶液,加入过量KBr,加 酸化,溶液颜色呈棕黄色;
酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 mL废水;
mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b
 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液
溶液 mL。
mL。
已知:
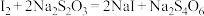
 和
和 溶液颜色均为无色
溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和_______ 。
(2)Ⅱ中发生反应的离子方程式是_______ 。
(3)Ⅲ中发生反应的化学方程式是_______ 。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是_______ 。
(5)KI与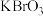 物质的量关系为
物质的量关系为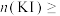
_______  时(此空填写数字),则可确保KI一定过量。
时(此空填写数字),则可确保KI一定过量。
(6)Ⅴ中滴定至终点的现象是_______ 。
(7)废水中苯酚的含量为_______  (苯酚摩尔质量:94
(苯酚摩尔质量:94 )。
)。
(8)由于 具有挥发性,Ⅱ~Ⅳ中反应须在密闭容器中进行。若在敞口容器中进行反应会造成测定结果
具有挥发性,Ⅱ~Ⅳ中反应须在密闭容器中进行。若在敞口容器中进行反应会造成测定结果_______ (偏高、偏低或者无影响)。
Ⅰ.用已准确称量的
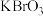 固体配制100mL的a
固体配制100mL的a 
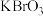 标准溶液;
标准溶液;Ⅱ.取
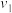 mL上述溶液,加入过量KBr,加
mL上述溶液,加入过量KBr,加 酸化,溶液颜色呈棕黄色;
酸化,溶液颜色呈棕黄色;Ⅲ.向Ⅱ所得溶液中加入
 mL废水;
mL废水;Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b

 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液
溶液 mL。
mL。已知:
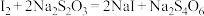
 和
和 溶液颜色均为无色
溶液颜色均为无色(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(2)Ⅱ中发生反应的离子方程式是
(3)Ⅲ中发生反应的化学方程式是
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是
(5)KI与
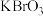 物质的量关系为
物质的量关系为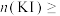
 时(此空填写数字),则可确保KI一定过量。
时(此空填写数字),则可确保KI一定过量。(6)Ⅴ中滴定至终点的现象是
(7)废水中苯酚的含量为
 (苯酚摩尔质量:94
(苯酚摩尔质量:94 )。
)。(8)由于
 具有挥发性,Ⅱ~Ⅳ中反应须在密闭容器中进行。若在敞口容器中进行反应会造成测定结果
具有挥发性,Ⅱ~Ⅳ中反应须在密闭容器中进行。若在敞口容器中进行反应会造成测定结果
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】2023年9月,在杭州举办的亚运会开幕式上,我国首次使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,实现循环内的零排放。 加氢制甲醇的总反应可表示为:
加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
反应I:
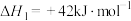
反应II:
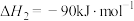
(1)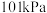 时,由元素最稳定的单质生成
时,由元素最稳定的单质生成 纯化合物时的反应焓叫做该化合物的标准摩尔生成焓。已知
纯化合物时的反应焓叫做该化合物的标准摩尔生成焓。已知 、
、 和
和 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为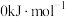 、
、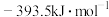 和
和 ,则
,则 的标准摩尔生成焓为
的标准摩尔生成焓为___________ 。
(2)若反应I为慢反应,下列示意图中能体现总反应进程能量变化的是___________(填标号)。
(3)向一绝热恒容密闭容器中充入等物质的量的 和
和 进行总反应,下面不能判断该反应已达到平衡状态的是
进行总反应,下面不能判断该反应已达到平衡状态的是___________ 。
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.单位时间内生成 ,同时生成
,同时生成
E. 和
和 的体积比保持不变
的体积比保持不变
(4)若在恒压反应器中,通入 和
和 ,发生I、II反应,总压为
,发生I、II反应,总压为 ,平衡时
,平衡时 转化率为50%,甲醇的分压为p,则反应I的
转化率为50%,甲醇的分压为p,则反应I的
___________ 。(用含p和 的计算式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
的计算式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)某小组在合成总反应时,研究了初始投料比不变,不同条件下达到平衡时,体系中甲醇的物质的量分数为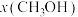 ,在
,在 ℃下的*
℃下的*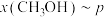 ,在
,在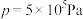 下的
下的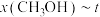 变化关系,如下图所示。
变化关系,如下图所示。

①则图中对应等温过程的曲线是___________ ,判断的理由是___________ 。
②当 时,
时, 的平衡转化率
的平衡转化率
___________ (保留三位有效数字),反应条件可能为___________ 或___________ 。
 加氢制甲醇的总反应可表示为:
加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
反应I:

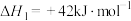
反应II:

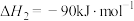
(1)
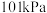 时,由元素最稳定的单质生成
时,由元素最稳定的单质生成 纯化合物时的反应焓叫做该化合物的标准摩尔生成焓。已知
纯化合物时的反应焓叫做该化合物的标准摩尔生成焓。已知 、
、 和
和 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为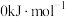 、
、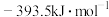 和
和 ,则
,则 的标准摩尔生成焓为
的标准摩尔生成焓为(2)若反应I为慢反应,下列示意图中能体现总反应进程能量变化的是___________(填标号)。
A. | B. |
C. | D.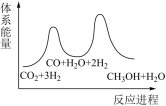 |
(3)向一绝热恒容密闭容器中充入等物质的量的
 和
和 进行总反应,下面不能判断该反应已达到平衡状态的是
进行总反应,下面不能判断该反应已达到平衡状态的是A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.单位时间内生成
 ,同时生成
,同时生成
E.
 和
和 的体积比保持不变
的体积比保持不变(4)若在恒压反应器中,通入
 和
和 ,发生I、II反应,总压为
,发生I、II反应,总压为 ,平衡时
,平衡时 转化率为50%,甲醇的分压为p,则反应I的
转化率为50%,甲醇的分压为p,则反应I的
 的计算式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
的计算式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(5)某小组在合成总反应时,研究了初始投料比不变,不同条件下达到平衡时,体系中甲醇的物质的量分数为
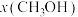 ,在
,在 ℃下的*
℃下的*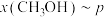 ,在
,在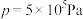 下的
下的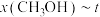 变化关系,如下图所示。
变化关系,如下图所示。
①则图中对应等温过程的曲线是
②当
 时,
时, 的平衡转化率
的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
___________ 。
(2)下列关于该反应的说法不正确的是___________。
(3)工业上通入过热水蒸气 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应
①反应中通入水蒸气的作用是___________
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为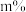 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
___________ (分压 总压
总压 物质的量分数)
物质的量分数)
(4)保持温度为 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应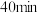 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线___________ 。

 ;
;

| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热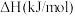 |  |  |  |
| A.高温、低压有利于该反应平衡正向进行 |
| B.高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化效果下降 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,可使乙苯的平衡转化率变大 |
 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应①反应中通入水蒸气的作用是
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为
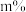 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
 总压
总压 物质的量分数)
物质的量分数)(4)保持温度为
 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应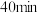 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业上以铬铁矿( ,含
,含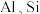 氧化物等杂质)为主要原料制备红矾钠
氧化物等杂质)为主要原料制备红矾钠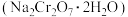 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:

(1)焙烧的目的是将 转化为
转化为 并将
并将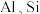 氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是_______ 。
(2)矿物中相关元素可溶性组分物质的量浓度c与 的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol/L时,可认为已除尽。
的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol/L时,可认为已除尽。

中和时 的理论范围为
的理论范围为_______ ;酸化的目的是_______ ; 元素在
元素在_______ (填操作单元的名称)过程中除去。
(3)蒸发结晶时,过度蒸发将导致_______ ;冷却结晶所得母液中,除 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有_______ 。
 ,含
,含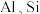 氧化物等杂质)为主要原料制备红矾钠
氧化物等杂质)为主要原料制备红矾钠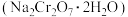 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
(1)焙烧的目的是将
 转化为
转化为 并将
并将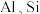 氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是(2)矿物中相关元素可溶性组分物质的量浓度c与
 的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol/L时,可认为已除尽。
的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol/L时,可认为已除尽。
中和时
 的理论范围为
的理论范围为 元素在
元素在(3)蒸发结晶时,过度蒸发将导致
 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
回答下列问题:
(1)反应之前先将矿石粉碎的目的是______________________________________ 。
(2)步骤③加的试剂为_____________ ,此时溶液pH要调到5的目的________________ 。
(3)写出反应④的离子反应方程式____________________________________________ 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式_________________ 。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是__________________ (填操作名称)。
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为___________ ,固体D中含Fe化合物的物质的量为____________ 。


查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
| 开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
| 沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是
(2)步骤③加的试剂为
(3)写出反应④的离子反应方程式
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为 ,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备
,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备 ,工艺流程图所示:
,工艺流程图所示:

(1)为了提高“溶浸”效果,可采取的措施有___________ 。(任写两条)
(2)“除铁”时,先加入 溶液发生的离子方程式为
溶液发生的离子方程式为___________ ,如果用 代替
代替 ,恰好完全反应时,理论上消耗
,恰好完全反应时,理论上消耗
___________ 。
(3)常温下,“调 ”时,
”时, 的浓度降到了
的浓度降到了 ,此时
,此时 的溶度积常数的数值为
的溶度积常数的数值为___________ 。
(4)“沉锌”时,在近中性条件下加入 ,可得碱式碳酸锌[
,可得碱式碳酸锌[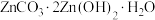 ]固体,同时产生大量的
]固体,同时产生大量的 气体。该反应的离子方程式为
气体。该反应的离子方程式为___________ 。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。

①基态Zn原子价电子排布式为___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③该铜锌合金晶体密度为___________  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备
,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备 ,工艺流程图所示:
,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有
(2)“除铁”时,先加入
 溶液发生的离子方程式为
溶液发生的离子方程式为 代替
代替 ,恰好完全反应时,理论上消耗
,恰好完全反应时,理论上消耗
(3)常温下,“调
 ”时,
”时, 的浓度降到了
的浓度降到了 ,此时
,此时 的溶度积常数的数值为
的溶度积常数的数值为(4)“沉锌”时,在近中性条件下加入
 ,可得碱式碳酸锌[
,可得碱式碳酸锌[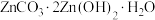 ]固体,同时产生大量的
]固体,同时产生大量的 气体。该反应的离子方程式为
气体。该反应的离子方程式为(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为anm。

①基态Zn原子价电子排布式为
②与Cu原子等距离且最近的Cu原子有
③该铜锌合金晶体密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
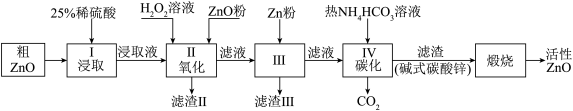
已知各相关氢氧化物沉淀pH范围如下表所示:
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要_____ (选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是_________________________ (用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________ 。
(4)步骤III中加入Zn粉的作用是:①__________________ ;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________ 。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是________ ;所得活性氧化锌的纯度为________ (相对原子质量 O-16 Zn-65 )。

已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是
(4)步骤III中加入Zn粉的作用是:①
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】 是接触法制硫酸的催化剂,使用后的废钒催化剂可回收利用。
是接触法制硫酸的催化剂,使用后的废钒催化剂可回收利用。
(1)接触室中发生的反应为: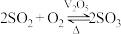 ,催化氧化过程中钒元素的变化如图所示。
,催化氧化过程中钒元素的变化如图所示。_______ 。
②过程c发生反应的化学方程式为_______ 。
(2)一种处理废钒催化剂的流程如下:
①酸浸时,加入试剂后,为提高钒元素浸出率可采取的方法有加速搅拌和_______ 。
② 发生“酸浸还原”反应的离子方程式为
发生“酸浸还原”反应的离子方程式为_______ 。
③萃取过程可简化为(萃取剂 可表示为HA):
可表示为HA): 。反萃取操作中加入
。反萃取操作中加入 的作用是
的作用是_______ 。
④用沉钒率( 沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。沉钒率随温度变化的关系曲线如图所示,沉钒时,温度超过
沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。沉钒率随温度变化的关系曲线如图所示,沉钒时,温度超过 以后,沉钒率下降的可能原因是
以后,沉钒率下降的可能原因是_______ 。 在密闭容器中加热,测得残留固体的质量随温度变化如图所示。B点剩余固体产物为
在密闭容器中加热,测得残留固体的质量随温度变化如图所示。B点剩余固体产物为_______ (写出计算过程)。
 是接触法制硫酸的催化剂,使用后的废钒催化剂可回收利用。
是接触法制硫酸的催化剂,使用后的废钒催化剂可回收利用。(1)接触室中发生的反应为:
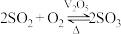 ,催化氧化过程中钒元素的变化如图所示。
,催化氧化过程中钒元素的变化如图所示。
②过程c发生反应的化学方程式为
(2)一种处理废钒催化剂的流程如下:
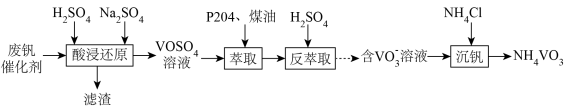
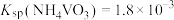
①酸浸时,加入试剂后,为提高钒元素浸出率可采取的方法有加速搅拌和
②
 发生“酸浸还原”反应的离子方程式为
发生“酸浸还原”反应的离子方程式为③萃取过程可简化为(萃取剂
 可表示为HA):
可表示为HA): 。反萃取操作中加入
。反萃取操作中加入 的作用是
的作用是④用沉钒率(
 沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。沉钒率随温度变化的关系曲线如图所示,沉钒时,温度超过
沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。沉钒率随温度变化的关系曲线如图所示,沉钒时,温度超过 以后,沉钒率下降的可能原因是
以后,沉钒率下降的可能原因是
 在密闭容器中加热,测得残留固体的质量随温度变化如图所示。B点剩余固体产物为
在密闭容器中加热,测得残留固体的质量随温度变化如图所示。B点剩余固体产物为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________ 。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
加入NaOH溶液调pH=5可除去图中的________ (填金属离子符号)杂质;写出除去金属离子的离子方程式________________________ (一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq) MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________ 。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________ (填“增大”或“减小”);两种萃取剂中___________ (填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________ mol·L−1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________ mol·L−1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=______ (lg5=0.7)。

已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)
 MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
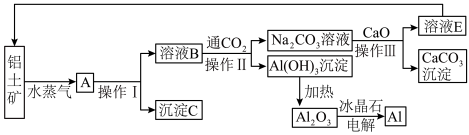
请回答下列问题:
(1)沉淀C的化学式为____ ,C与金属Al可以在高温下发生反应,可用于焊接铁轨。则该反应的化学方程式为_________ 。
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是____ (填操作名称),实验室要洗涤Al(OH)3沉淀,洗涤方法是____________ 。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有______ (填化学式)。用此法制取铝的副产品是______ (填化学式)。
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解: ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____ g铝。
下列有关此工艺的说法合理的是______
A.冰晶石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___ (填化学式)。

请回答下列问题:
(1)沉淀C的化学式为
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
 ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成下列有关此工艺的说法合理的是
A.冰晶石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
您最近一年使用:0次



