解题方法
1 . 碳、氮、氧、磷、硫、铁,锌、铜等都是组成蛋白质的重要元素。回答下列问题:
(1)Fe的基态原子的核外电子排布式为______ 。
(2)在C、N、O、P、S五种元素中,第一电离能最大的元素是______ (填元素符号,下同),电负性最大的元素是______
(3)氨基乙酸(H2NCH2COOH)是蛋白质完全水解的产物之一,其中C原子的杂化轨道类型为______ ;1molH2NCH2COOH中含有σ键的数目为______ NA。
(4)蛋白质在体内部分被氧化生成尿素[CO(NH2)2]、二氧化碳、水等排出体外。
①H2O分子的空间构型为______ 。
②尿素易溶于水,其原因除都是极性分子外,还有______ 。
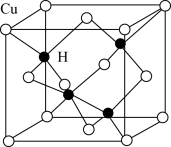
(5)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为______ 。若该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的棱长为______ nm(用含ρ和NA的式子表示)
(1)Fe的基态原子的核外电子排布式为
(2)在C、N、O、P、S五种元素中,第一电离能最大的元素是
(3)氨基乙酸(H2NCH2COOH)是蛋白质完全水解的产物之一,其中C原子的杂化轨道类型为
(4)蛋白质在体内部分被氧化生成尿素[CO(NH2)2]、二氧化碳、水等排出体外。
①H2O分子的空间构型为
②尿素易溶于水,其原因除都是极性分子外,还有
(5)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为

您最近一年使用:0次
解题方法
2 . N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____ O(填“ ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S____ Cl。
(2) 的沸点比
的沸点比 高的原因是
高的原因是___________ ; 属于
属于________ (填“极性”或“非极性”)分子,
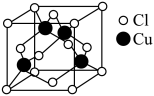
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________ 。
(1)第一电离能:N
 ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S(2)
 的沸点比
的沸点比 高的原因是
高的原因是 属于
属于(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
名校
解题方法
3 . 现有四种元素的基态原子的电子排布式如下:
① 1s22s22p4 ② 1s22s22p63s23p3 ③ 1s22s22p3 ④ 1s22s22p5
则下列有关比较中正确的是( )
① 1s22s22p4 ② 1s22s22p63s23p3 ③ 1s22s22p3 ④ 1s22s22p5
则下列有关比较中正确的是( )
| A.最高正化合价:④>①>③=② | B.电负性:④>①>③>② |
| C.原子半径:④>③>②>① | D.第一电离能:④>③>①>② |
您最近一年使用:0次
解题方法
4 . 短周期主族元素 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的最高正价与最低负价代数和为0,
的最高正价与最低负价代数和为0, 、
、 、
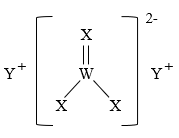
、 形成的化合物甲的结构如图所示,
形成的化合物甲的结构如图所示, 在同周期中原子半径最小。下列说法正确的是( )
在同周期中原子半径最小。下列说法正确的是( )
 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的最高正价与最低负价代数和为0,
的最高正价与最低负价代数和为0, 、
、 、
、 形成的化合物甲的结构如图所示,
形成的化合物甲的结构如图所示, 在同周期中原子半径最小。下列说法正确的是( )
在同周期中原子半径最小。下列说法正确的是( )
A.原子半径大小: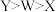 |
B.电负性大小: |
C. 、 、 形成的化合物为离子化合物 形成的化合物为离子化合物 |
| D.化合物甲中阴离子的空间构型为三角锥形 |
您最近一年使用:0次
名校
5 . 下列各组元素中,电负性依次减小的是
| A.O、Cl、H | B.K、Na、Al | C.As、P、H | D.O、S、Cl |
您最近一年使用:0次
2020-04-27更新
|
377次组卷
|
11卷引用:海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题
海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题海南省海南鑫源高级中学2020-2021学年高二下学期第一次月考化学试题2015-2016学年湖北省长阳一中高二第一学期第一次月考化学试卷2014-2015学年宁夏平罗中学高二上学期期中化学试卷河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题新疆喀什地区巴楚县第一中学2020-2021学年高二上学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修21.2.2 元素周期律-课堂例题
6 . 已知 元素原子的价电子排布式为
元素原子的价电子排布式为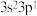 ,
, 元素位于周期表中第三周期,其原子最外层
元素位于周期表中第三周期,其原子最外层 轨道为半充满状态,下列叙述错误的是( )
轨道为半充满状态,下列叙述错误的是( )
 元素原子的价电子排布式为
元素原子的价电子排布式为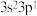 ,
, 元素位于周期表中第三周期,其原子最外层
元素位于周期表中第三周期,其原子最外层 轨道为半充满状态,下列叙述错误的是( )
轨道为半充满状态,下列叙述错误的是( )A. 为金属元素, 为金属元素, 为非金属元素 为非金属元素 |
B. 与 与 为同周期元素 为同周期元素 |
C. 的电负性大于 的电负性大于 |
D. 的第一电离能大于 的第一电离能大于 |
您最近一年使用:0次
2020-03-04更新
|
238次组卷
|
10卷引用:海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题
海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题人教化学选修3第一章第二节课时4第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题广东省汕尾市2021-2022学年高二上学期期末考试化学试题福建省三明市宁化第六中学2021-2022学年高二下学期第一次月考化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题广东省揭阳市惠来县第一中学2021-2022学年高二下学期第一次阶段考试化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
7 . 下列叙述中正确的个数有( )
①氧原子的电子排布图: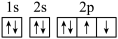 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
①氧原子的电子排布图:
 最外层违背了泡利原理
最外层违背了泡利原理②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
2019-11-27更新
|
1595次组卷
|
9卷引用:海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题
海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题(人教版2019)选择性必修2 阶段性综合评估测试卷(一)重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题重庆市南华中学校2021-2022学年高二3月月考化学试题重庆实验外国语学校2021-2022学年高二下学期6月月考化学试题湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题
8 . (1)元素C、N、O、K的电负性从大到小依次为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______ 。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______ (填“A”“B”“C”或“D”)。

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______ ;B和N相比,电负性较大的是______ ,BN中B元素的化合价为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为
您最近一年使用:0次
2019-07-07更新
|
183次组卷
|
3卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同
9 . 由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________ ,P、S、Cl的第一电离能由大到小顺序为____________________ ,P、S、Cl的电负性由大到小顺序为_______________ 。
(2)SCl2分子中的中心原子杂化轨道类型是_____________ ,该分子构型为__________ 。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______ ;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________ 。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____ NiO(填“>”、“<”或“=”),理由是_______________________________ 。
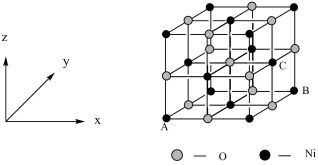
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______ 。
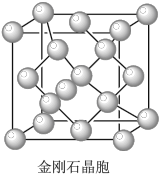
(6)金刚石晶胞含有____ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______ a,列式表示碳原子在晶胞中的空间占有率____ (请用r和a表示不要求计算结果)。
(1)基态 Cl原子核外电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为

(6)金刚石晶胞含有
您最近一年使用:0次
2019-04-12更新
|
311次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
解题方法
10 . 锰及其化合物用途非常广泛。回答下列问题:
(1)基态Mn原子的电子排布式为_________ 。
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是____________ 。
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
③配体CO的等电子体有:_________ (任写一种),N2O的分子空间构型为__________ 。
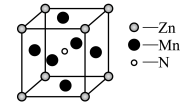
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:_________ ;若晶胞边长为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)基态Mn原子的电子排布式为
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
③配体CO的等电子体有:
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:

您最近一年使用:0次
2019-02-23更新
|
445次组卷
|
2卷引用:2021年海南高考化学试题变式题11-19



