名校
1 . “医用酒精”和“84消毒液”混合,可产生 等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是
等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是
 等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是
等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是A.简单离子半径: | B. 分子为非极性分子 分子为非极性分子 |
C.电负性: | D.Z与Q形成的常见化合物中阴阳离子个数比1∶2 |
您最近一年使用:0次
2 . 冠醚是由多个二元醇分子之间失水形成的环状醚,X是其中的一种, 因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中
因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中 与氧原子间能形成化学键。下列说法中错误的是
与氧原子间能形成化学键。下列说法中错误的是

 因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中
因其体积大小与X的空腔大小相近而恰好能进入X的环内形成超分子Y,Y中 与氧原子间能形成化学键。下列说法中错误的是
与氧原子间能形成化学键。下列说法中错误的是
| A.X可形成分子晶体 | B.Y中 与氧原子间形成的是离子键 与氧原子间形成的是离子键 |
| C.K⁺不能与X形成超分子 | D.电负性:O>C>Li |
您最近一年使用:0次
2023-04-22更新
|
250次组卷
|
2卷引用:海南省海口市2023届高三下学期4月学生学科能力诊断化学试题
名校
解题方法
3 . 研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜的晶胞结构如下图所示,铜原子的配位数为_______ ,基态铜原子价层电子排布式为_______ 。

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为_______ ;
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是_______ 。
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是_______ , 的空间构型为
的空间构型为_______ 。
(1)铜的晶胞结构如下图所示,铜原子的配位数为

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为
您最近一年使用:0次
解题方法
4 . 腈类化合物是一类含氰基(-C≡N)的重要有机化合物,可以用作农药、香料、金属缓蚀剂或液晶材料等,氨氧化法是丙烯腈的重要生产方法,反应原理如下:
CH2=CH-CH3(丙烯)+NH3+O2 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)
(1)丙烯分子中碳原子的杂化方式为_____ ,丙烯腈分子中σ键与π键的数目比为_____ 。
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为_____ ,原因是_____ 。
(3)键角:NH3_____ (填“>”、“<”或“=”)H2O,原因是_____ 。
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH_____ (填“>”、“<”或“=”)CH3CHClCOOH。
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为_____ 。
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为_____ pm,金属钼的密度为_____ g•cm-3。
CH2=CH-CH3(丙烯)+NH3+O2
 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)(1)丙烯分子中碳原子的杂化方式为
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为
(3)键角:NH3
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为
您最近一年使用:0次
2023-01-17更新
|
160次组卷
|
3卷引用:海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题
海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题新疆维吾尔自治区部分名校2022-2023学年高三上学期期末大联考化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)
5 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为____ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是______ 。
(2)甘氨酸H2N-CH2-COOH中N的杂化轨道类型为__________ ;甘氨酸易溶于水,试从结构角度解释__________ 。
(3)一水合甘氨酸锌中Zn2+的配位数为__________ 。
(4)Zn与S形成某种化合物的晶胞如图所示。
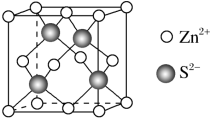
①Zn与S形成某种化合物的化学式__________ ;
②已知晶胞的边长为a pm,则晶体密度:__________ g/cm3 (写计算表达式)。

(1)基态Zn2+的价电子排布式为
(2)甘氨酸H2N-CH2-COOH中N的杂化轨道类型为
(3)一水合甘氨酸锌中Zn2+的配位数为
(4)Zn与S形成某种化合物的晶胞如图所示。

①Zn与S形成某种化合物的化学式
②已知晶胞的边长为a pm,则晶体密度:
您最近一年使用:0次
名校
6 . 新型光催化剂Zn2GeO4具有较高的催化活性。下列有关其组成元素的说法正确的是
| A.Zn处于元素周期表中的d区 |
| B.Ge的价电子排布式为3d104s24p2 |
| C.基态O原子中成对电子数是未成对电子数的2倍 |
| D.三种元素电负性由大到小的顺序是:O>Ge>Zn |
您最近一年使用:0次
2022-12-14更新
|
245次组卷
|
2卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同
名校
7 . 回答下列问题:
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有_______ 种不同空间运动状态的电子,其最高能级的电子云形状为_______ 。
(2)过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
回答下列问题:
①对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比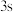 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。

 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的,分析原因:
的,分析原因:_______ 。
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有
(2)过渡金属元素铬
 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
①对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比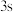 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的,分析原因:
的,分析原因:
您最近一年使用:0次
8 . 下列关于原子结构与元素周期表的说法正确的是
| A.电负性最大的元素位于周期表的左下角 |
| B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期第ⅢA族 |
| C.2s轨道在空间呈哑铃形 |
| D.第四能层最多可容纳16个电子 |
您最近一年使用:0次
2022-12-10更新
|
98次组卷
|
2卷引用:海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题
解题方法
9 . 有W、X,Y、Z、M五种元素,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,W的单质是密度最小的气体,X、Z同主族,且Z的原子序数是X的2倍,Y是所在周期中原子半径最小的金属元素,M为金属元素,其相对原子质量是Z的2倍。回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序是_______ (用元素符号表示)。
(2)五种元素中形成的二元化合物分子含18电子的有_______ (用化学式表示),写出其中一种分子的电子式:_______ 。
(3)甲为X,M元素形成的黑色化合物,甲与 ,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:
,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:_______ 。
(4)写出Z的+4价氧化物在酸性环境中被 氧化为Z的最高价氧化物对应的水化物的离子方程式:
氧化为Z的最高价氧化物对应的水化物的离子方程式:_______ 。
(5)电解熔融状态Y的氧化物生成Y的单质的反应中,生成2.7g固体时,收集到的气体为_______ mL(标准状况)。
(1)X、Y、Z的电负性由大到小的顺序是
(2)五种元素中形成的二元化合物分子含18电子的有
(3)甲为X,M元素形成的黑色化合物,甲与
 ,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:
,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:(4)写出Z的+4价氧化物在酸性环境中被
 氧化为Z的最高价氧化物对应的水化物的离子方程式:
氧化为Z的最高价氧化物对应的水化物的离子方程式:(5)电解熔融状态Y的氧化物生成Y的单质的反应中,生成2.7g固体时,收集到的气体为
您最近一年使用:0次
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
| A.化合物WX2的空间构型为直线型 | B.化合物YX为离子晶体 |
| C.Z的最高价氧化物对应水化物的酸性比W的弱 | D.W的电负性比X的强 |
您最近一年使用:0次



