名校
解题方法
1 . 青霉胺可以用于医学上误食铜盐的解毒,解毒原理: 形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
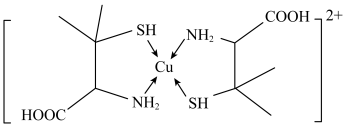
 形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法正确的是
A.共价键键角的大小关系为: |
B.电负性大小关系为: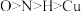 |
| C.该配合物易溶于水的主要原因是其与水可形成分子间氢键 |
D.与铜离子形成配位键强弱的大小关系为: |
您最近一年使用:0次
名校
2 . 类比推理是学习化学的重要的思维方法,下列陈述I及类比推理陈述Ⅱ均正确的是
| 选项 | 陈述I | 类比推理陈述II |
| A | 在空气中加热, 生成 生成 | 在空气中加热, 也生成 也生成 |
| B | 酸性: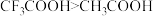 | 碱性: |
| C |  是强酸 是强酸 |  也是强酸 也是强酸 |
| D | 通入 可增强漂白粉溶液漂白性 可增强漂白粉溶液漂白性 | 通入 也可增强漂白粉溶液漂白性 也可增强漂白粉溶液漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻,X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确 的是
A.第一电离能: |
B.电负性: |
C.Z、W原子形成稀有气体电子构型的简单离子的半径: |
D.Y与Z形成的分子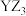 中每个原子均满足 中每个原子均满足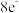 结构 结构 |
您最近一年使用:0次
2024-01-09更新
|
459次组卷
|
3卷引用:海南省农垦中学2023-2024学年高二上学期期中检测化学试题
名校
4 . 法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法正确的是


A.该分子的分子式为 |
B.该分子中相邻C原子之间均以 杂化轨道重叠形成σ键 杂化轨道重叠形成σ键 |
| C.组成该分子的所有元素中氟的电负性最大 |
| D.该分子中有2个手性碳原子 |
您最近一年使用:0次
5 .  固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有:
(1)一个基态氧原子的价层电子轨道表示式为___________ ;基态碳原子核外有___________ 个未成对电子。
(2)乙中所含元素电负性由大到小的顺序为___________ (填元素符号),乙中碳原子的杂化类型是___________ 。
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是___________ 。
(4)配离子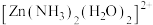 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是___________ 。
(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为___________ nm。
 固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有: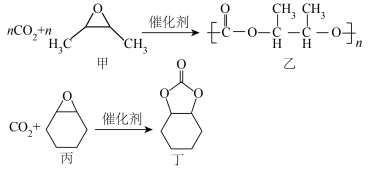
(1)一个基态氧原子的价层电子轨道表示式为
(2)乙中所含元素电负性由大到小的顺序为
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是
(4)配离子
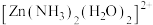 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为
 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为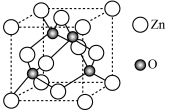
您最近一年使用:0次
2023-12-23更新
|
83次组卷
|
2卷引用:2024届海南省高三上学期12月一轮复习调研考试化学试题
名校
解题方法
6 . 一氯化碘(ICl)、三氯化碘(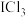 )是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn=ZnI2+ZnCl2,以下判断正确的是
)是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn=ZnI2+ZnCl2,以下判断正确的是
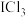 )是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn=ZnI2+ZnCl2,以下判断正确的是
)是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn=ZnI2+ZnCl2,以下判断正确的是A.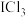 与水反应的产物为HI和HClO 与水反应的产物为HI和HClO |
B.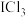 与KI反应时,氯元素被还原 与KI反应时,氯元素被还原 |
| C.ICl与冷NaOH溶液反应的离子方程式为ICl+2OH−=IO−+Cl−+H2O |
| D.ICl与水的反应不属于氧化还原反应 |
您最近一年使用:0次
2023-12-18更新
|
75次组卷
|
2卷引用:海南省海口市琼山华侨中学2023-2024学年高三上学期第二次月考化学试题
7 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。回答下列问题:

(1)j元素基态原子的电子排布式是___________ 。
(2)元素k位于周期表中___________ 区,其基态原子有___________ 个未成对电子,有___________ 种空间运动状态不同的电子。
(3)下列正确的是___________。
(4)基态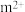 的离子结构示意图为
的离子结构示意图为___________ ,已知高温下化合物 比化合物
比化合物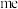 更稳定,试从
更稳定,试从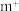 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因___________ 。
(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第___________ 周期、第___________ 族。

(1)j元素基态原子的电子排布式是
(2)元素k位于周期表中
(3)下列正确的是___________。
A.原子半径 | B.第一电离能 |
C.电负性 | D.最高价氧化物的水化物的酸性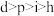 |
(4)基态
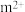 的离子结构示意图为
的离子结构示意图为 比化合物
比化合物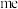 更稳定,试从
更稳定,试从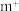 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因(5)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与
 溶液反应的离子方程式
溶液反应的离子方程式(6)传闻某国合成了第166号元素,若已知原子结构规律不变,该元素应是第
您最近一年使用:0次
名校
解题方法
8 . 氮族、氧族、卤族等在生活生产中都有重要应用。回答下列问题:
(1)NH3分子的VSEPR模型名称为___________ 。配合物 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者_____ 后者(填“大于”“小于”或“相同”),其原因是___________ 。
(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测 离子的空间结构为
离子的空间结构为___________ 。
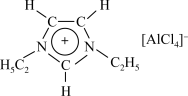
(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大 键可以用
键可以用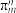 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为___________ 。为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的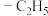 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:___________ 。
② 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式___________ 。
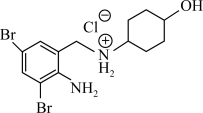
(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、___________ ,这种盐中C原子的杂化轨道的类型为___________ 。
(1)NH3分子的VSEPR模型名称为
 中的H—N—H的键角与游离的
中的H—N—H的键角与游离的 分子的键角比较,前者
分子的键角比较,前者(2)已知斥力大小:孤电子对-孤电子对>孤电子对-成键电子对,预测
 离子的空间结构为
离子的空间结构为(3)①离子液体优异性能不断被开发利用。常见的离子液体含有如图中的离子等,已知微粒中的大
 键可以用
键可以用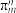 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则阳离子中的大
键中的电子数,则阳离子中的大 键可以表示为
键可以表示为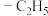 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:
②
 也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出
也可以形成离子液体,这种离子中所有原子均满足8电子稳定结构,请写出 的结构式
的结构式(4)为提高含氮碱性有机药物的水溶性,常用它们的盐酸盐。例如盐酸氨溴索(结构见如图)的阳离子可与水形成氢键,这些氢键表示式为O—H∙∙∙O(H2O)、

您最近一年使用:0次
名校
解题方法
9 . 已知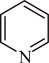 为平面分子,下列说法正确的是
为平面分子,下列说法正确的是

 为平面分子,下列说法正确的是
为平面分子,下列说法正确的是
A.反应物中C、N、O原子均采用 杂化 杂化 | B.电负性大小:N>O>C>H |
| C.产物中Al的配位数是5 | D.产物中Al的化合价是 价 价 |
您最近一年使用:0次
名校
解题方法
10 . C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外最外层电子排布式______ ,C、O、Si三种元素的电负性由大到小的顺序为______ 。
(2)干冰是分子晶体,其密度比冰大的原因是____________ 。
(3)氧化物XO的电子总数与SiC的相等,则X为______ (填元素符号),XO是优良的耐高温材料,其熔点比CaO高的原因是__________________ 。
(4)在30 g 晶体中含
晶体中含______ mol Si-O键。
(1)写出Si的基态原子核外最外层电子排布式
(2)干冰是分子晶体,其密度比冰大的原因是
(3)氧化物XO的电子总数与SiC的相等,则X为
(4)在30 g
 晶体中含
晶体中含
您最近一年使用:0次



