名校
解题方法
1 . 下列说法中,正确的是
| A.N、P、S的第一电离能依次减小 | B.Li、Na、K的电负性依次增大 |
| C.F、O、Na的原子半径依次减小 | D.甲烷、氨气、水的键角依次增大 |
您最近一年使用:0次
名校
2 . 下表为元素周期表前三周期的一部分:
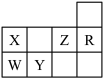
(1)Y的基态原子的电子排布式为___________ 。
(2)X的氢化物的沸点与W的氢化物的沸点比较:________ >_______ (填化学式),原因是________ 。
(3)选出X的基态原子的电子排布图___________ ,另一电子排布图不能作为基态原子的电子排布图是因为它不符合___________ (填序号)。

A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,___________ (填元素符号)元素第一电离能最大,___________ 元素的电负性最大。
(5)由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如下图所示,则下列判断错误的是___________ 。
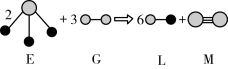
A.G是最活泼的非金属单质
B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键

(1)Y的基态原子的电子排布式为
(2)X的氢化物的沸点与W的氢化物的沸点比较:
(3)选出X的基态原子的电子排布图

A.能量最低原理 B.泡利原理 C.洪特规则
(4)以上五种元素中,
(5)由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如下图所示,则下列判断错误的是

A.G是最活泼的非金属单质
B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键
您最近一年使用:0次
名校
解题方法
3 . 按要求填空。
(1)一个基态原子电子排布为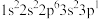 的元素最可能的价态是
的元素最可能的价态是___________ ;某元素原子的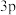 原子轨道中有3个未成对电子,则该原子的
原子轨道中有3个未成对电子,则该原子的价电子轨道表示式 为___________ 。
(2)第四周期中,未成对电子数目最多的元素是___________ ;价层电子排布式为 的基态原子的原子结构示意图
的基态原子的原子结构示意图___________ 。
(3)元素周期表中能稳定存在且电负性相差最大的两种元素形成的化合物的化学式为_______ 。
(4) 三种短周期元素的原子序数
三种短周期元素的原子序数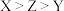 ,X和Z原子核外s电子与p电子数之比都为
,X和Z原子核外s电子与p电子数之比都为 ,Y原子最外层s电子与p电子数之比为
,Y原子最外层s电子与p电子数之比为 ,
,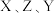 三者所形成的常见化合物的化学式为
三者所形成的常见化合物的化学式为_____ 。
(1)一个基态原子电子排布为
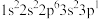 的元素最可能的价态是
的元素最可能的价态是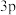 原子轨道中有3个未成对电子,则该原子的
原子轨道中有3个未成对电子,则该原子的(2)第四周期中,未成对电子数目最多的元素是
 的基态原子的原子结构示意图
的基态原子的原子结构示意图(3)元素周期表中能稳定存在且电负性相差最大的两种元素形成的化合物的化学式为
(4)
 三种短周期元素的原子序数
三种短周期元素的原子序数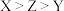 ,X和Z原子核外s电子与p电子数之比都为
,X和Z原子核外s电子与p电子数之比都为 ,Y原子最外层s电子与p电子数之比为
,Y原子最外层s电子与p电子数之比为 ,
,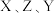 三者所形成的常见化合物的化学式为
三者所形成的常见化合物的化学式为
您最近一年使用:0次
名校
4 . X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表。下列说法错误的是
| 元素 | 相关信息 |
 |  的基态原子 的基态原子 层电子数是 层电子数是 层的2倍 层的2倍 |
 |  的基态原子最外层电子排布式为 的基态原子最外层电子排布式为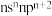 |
 |  存在质量数为23、中子数为12的核素 存在质量数为23、中子数为12的核素 |
 | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
A.W是 元素 元素 | B. 的电负性比 的电负性比 的大 的大 |
C.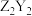 中阴离子和阳离子个数比为 中阴离子和阳离子个数比为 | D. 是一种直线形分子 是一种直线形分子 |
您最近一年使用:0次
名校
5 . 下列叙述错误 的是
A.熔点的高低: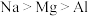 |
| B.硬度的大小:金刚石>碳化硅>晶体硅 |
C.磷化铜 用于制造磷青铜,电负性: 用于制造磷青铜,电负性: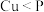 |
D.用原子轨道描述氟化氢分子中化学键的形成: |
您最近一年使用:0次
名校
解题方法
6 . 研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜的晶胞结构如下图所示,铜原子的配位数为_______ ,基态铜原子价层电子排布式为_______ 。

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为_______ ;
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是_______ 。
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是_______ , 的空间构型为
的空间构型为_______ 。
(1)铜的晶胞结构如下图所示,铜原子的配位数为

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为
您最近一年使用:0次
解题方法
7 . 腈类化合物是一类含氰基(-C≡N)的重要有机化合物,可以用作农药、香料、金属缓蚀剂或液晶材料等,氨氧化法是丙烯腈的重要生产方法,反应原理如下:
CH2=CH-CH3(丙烯)+NH3+O2 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)
(1)丙烯分子中碳原子的杂化方式为_____ ,丙烯腈分子中σ键与π键的数目比为_____ 。
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为_____ ,原因是_____ 。
(3)键角:NH3_____ (填“>”、“<”或“=”)H2O,原因是_____ 。
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH_____ (填“>”、“<”或“=”)CH3CHClCOOH。
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为_____ 。
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为_____ pm,金属钼的密度为_____ g•cm-3。
CH2=CH-CH3(丙烯)+NH3+O2
 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)(1)丙烯分子中碳原子的杂化方式为
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为
(3)键角:NH3
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为
您最近一年使用:0次
2023-01-17更新
|
160次组卷
|
3卷引用:海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题
海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题新疆维吾尔自治区部分名校2022-2023学年高三上学期期末大联考化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)
8 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为____ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是______ 。
(2)甘氨酸H2N-CH2-COOH中N的杂化轨道类型为__________ ;甘氨酸易溶于水,试从结构角度解释__________ 。
(3)一水合甘氨酸锌中Zn2+的配位数为__________ 。
(4)Zn与S形成某种化合物的晶胞如图所示。
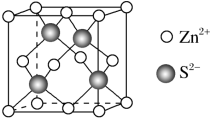
①Zn与S形成某种化合物的化学式__________ ;
②已知晶胞的边长为a pm,则晶体密度:__________ g/cm3 (写计算表达式)。

(1)基态Zn2+的价电子排布式为
(2)甘氨酸H2N-CH2-COOH中N的杂化轨道类型为
(3)一水合甘氨酸锌中Zn2+的配位数为
(4)Zn与S形成某种化合物的晶胞如图所示。

①Zn与S形成某种化合物的化学式
②已知晶胞的边长为a pm,则晶体密度:
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有_______ 种不同空间运动状态的电子,其最高能级的电子云形状为_______ 。
(2)过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
回答下列问题:
①对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比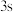 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。

 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的,分析原因:
的,分析原因:_______ 。
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有
(2)过渡金属元素铬
 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
①对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比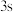 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的,分析原因:
的,分析原因:
您最近一年使用:0次
10 . 下列关于原子结构与元素周期表的说法正确的是
| A.电负性最大的元素位于周期表的左下角 |
| B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期第ⅢA族 |
| C.2s轨道在空间呈哑铃形 |
| D.第四能层最多可容纳16个电子 |
您最近一年使用:0次
2022-12-10更新
|
98次组卷
|
2卷引用:海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题



