锰及其化合物用途非常广泛。回答下列问题:
(1)基态Mn原子的电子排布式为_________ 。
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是____________ 。
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
③配体CO的等电子体有:_________ (任写一种),N2O的分子空间构型为__________ 。
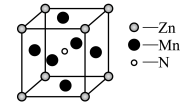
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:_________ ;若晶胞边长为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)基态Mn原子的电子排布式为
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
③配体CO的等电子体有:
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:

更新时间:2019-02-23 16:40:29
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】甲醇(CH3OH)是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_______ ,其核外电子共占据_______ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_______ ,其组成元素的电负性由小到大的顺序为_______ 。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为_______ 。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为_______ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________________________ 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________ (填“>”或“<”,下同)B;第一电离能:N________ O,原因是_________________________ 。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________________ 形,其中硫原子采用______________ 杂化,写出SO42-的一种等电子体的化学式:______________________ 。
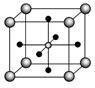
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围___________ 个O2-相紧邻。
(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________ (用代数式表示,不要求算出具体结果)。
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围

(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
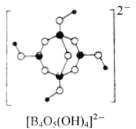
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
a.氢键 b.离子键 c.共价键 d.配位键
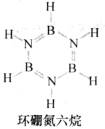
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
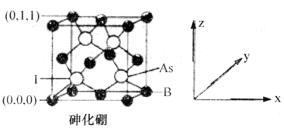
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: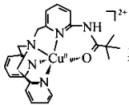 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布图为________ 。
②1 mol CH2=CH-CH2OH含有σ键的数目为________ ,烯丙醇分子中碳原子的杂化类型为___ 。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的阴离子为_____ 。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中σ键和π键数目比是________ 。
①基态镍原子的价电子排布图为
②1 mol CH2=CH-CH2OH含有σ键的数目为
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的阴离子为
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中σ键和π键数目比是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨有助于解决地球上粮食不足问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子,核外电子的运动状态有_______ 种,能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能I3(Fe)_______ I3(Mn)(填“>”或“<”),原因是_______ 。
②比较Li+与H-的半径大小关系: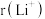
_______ 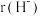 (填“>”或“<”)。
(填“>”或“<”)。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为 ,反应过程如图所示:
,反应过程如图所示:
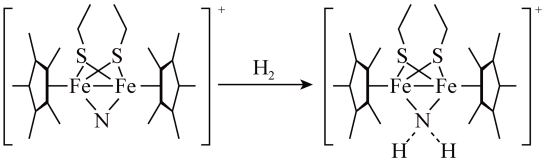
①产物中N原子的杂化轨道类型为_______ 。
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与 互为等电子体的分子
互为等电子体的分子_______ (填化学式)。
(1)基态N原子,核外电子的运动状态有
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能I3(Fe)
②比较Li+与H-的半径大小关系:
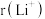
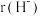 (填“>”或“<”)。
(填“>”或“<”)。(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为
 ,反应过程如图所示:
,反应过程如图所示:
①产物中N原子的杂化轨道类型为
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与
 互为等电子体的分子
互为等电子体的分子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为Na3AlF6 ,其中含有_______________________________ 等化学键。
(2)生成物中含有10个电子的分子是________ (写分子式),该分子的空间构型_______ ,中心原子的杂化方式为___________________ 。
(3)反应物中所含元素电负性最大的元素为________ (填元素符号),写出其原子最外层的电子排布图:_______________ ,它的氢化物的沸点比同主族其它氢化物的沸点高,原因是:_______________________________ 。
(4)冰晶石由两种微粒构成,它的晶胞结构如图甲所示,小黑点“●”位于大立方体的顶点和面心,小圆圈“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处小三角“∆”所代表的是__________ (填“小黑点”或“小圆圈”),它代表的是______________ (填微粒化学式)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
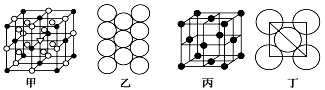
若已知Al的原子半径为d,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________ 个; Al晶体的密度为__________ (用字母表示)。
(1)冰晶石的化学式为Na3AlF6 ,其中含有
(2)生成物中含有10个电子的分子是
(3)反应物中所含元素电负性最大的元素为
(4)冰晶石由两种微粒构成,它的晶胞结构如图甲所示,小黑点“●”位于大立方体的顶点和面心,小圆圈“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处小三角“∆”所代表的是
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Cu、N都是重要的材料元素,其单质和化合物在诸多领域都有广泛的应用。
(1)单晶硅太阳能电池片加工时一般掺入微量的铜,Cu2+基态价电子排布式为_____________ 。
(2)配合物 [Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________ 。1mol [Cu(NH3)2]+中含有σ键的数目为____________ 。C、N、O元素的第一电离能由大到小的顺序是_____________ (用元素符号表示)。
(3)与NH3分子互为等电子体的阴离子为_______________ 。
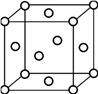
(4)铜晶胞结构如图所示,晶体中铜原子的配位数及每个晶胞中铜原子的数目之比为______________ 。
(1)单晶硅太阳能电池片加工时一般掺入微量的铜,Cu2+基态价电子排布式为
(2)配合物 [Cu(NH3)2]OOCCH3中碳原子的杂化类型是
(3)与NH3分子互为等电子体的阴离子为
(4)铜晶胞结构如图所示,晶体中铜原子的配位数及每个晶胞中铜原子的数目之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】以FeCl3、NH4H2PO4、LiCl和苯胺(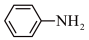 )为原料可制备磷酸亚铁锂(LiFePO4),LiFePO4可用作锂电池的正极材料。
)为原料可制备磷酸亚铁锂(LiFePO4),LiFePO4可用作锂电池的正极材料。
(1)基态Fe2+的电子排布式为______ 。
(2)N、P、O三种元素的电负性由大到小的顺序是______ 。
(3)NH4H2PO4中原子的轨道杂化方式为sp3杂化的原子有______ 。
(4)1mol苯胺分子中含有σ键的数目为______ 。
(5)LiCl、苯胺和甲苯的熔点由高到低的顺序是______ ,理由是______ 。
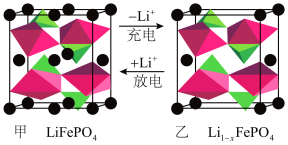
(6)LiFePO4的晶胞结构示意图如图甲所示(“●”为Li+,位置分别在顶角、棱中心和面心,正八面体和正四面体由O围绕Fe和P形成,它们通过共顶点、共棱形成空间链结构)。每个晶胞中含有LiFePO4的单元数为______ 。电池充电时,LiFePO4脱出Li+,形成Li1−xFePO4,结构示意图如图乙所示,x=______ 。
 )为原料可制备磷酸亚铁锂(LiFePO4),LiFePO4可用作锂电池的正极材料。
)为原料可制备磷酸亚铁锂(LiFePO4),LiFePO4可用作锂电池的正极材料。(1)基态Fe2+的电子排布式为
(2)N、P、O三种元素的电负性由大到小的顺序是
(3)NH4H2PO4中原子的轨道杂化方式为sp3杂化的原子有
(4)1mol苯胺分子中含有σ键的数目为
(5)LiCl、苯胺和甲苯的熔点由高到低的顺序是
(6)LiFePO4的晶胞结构示意图如图甲所示(“●”为Li+,位置分别在顶角、棱中心和面心,正八面体和正四面体由O围绕Fe和P形成,它们通过共顶点、共棱形成空间链结构)。每个晶胞中含有LiFePO4的单元数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷酸亚铁锂( )是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为___________ ;基态磷原子第一电离能比基态硫的___________ (填“大”或“小”),原因是___________ 。
(2)实验室中可用KSCN或 来检验
来检验 。
。 与KSCN溶液混合,可得到配位数为5的配合物的化学式是
与KSCN溶液混合,可得到配位数为5的配合物的化学式是___________ ,其中硫、碳的杂化类型分别是___________ 、___________ 。
(3)磷酸和亚磷酸( )是磷元素的两种含氧酸。
)是磷元素的两种含氧酸。 的空间构型为
的空间构型为___________ ;亚磷酸与NaOH反应只生成 和
和 两种盐,则
两种盐,则 的结构简式为
的结构简式为___________ 。
(4) 和
和 都是三角锥形分子,但键角
都是三角锥形分子,但键角 ,可能的原因是
,可能的原因是___________ 。
(5)氧化亚铁晶体的晶胞如图。已知:氧化亚铁晶体的密度为ρ g⋅cm ,
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与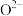 紧邻且等距离的
紧邻且等距离的 数目为
数目为___________ , 与
与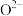 最短核间距为
最短核间距为___________ pm。
 )是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:(1)基态锂原子核外能量最高的电子电子云轮廓图形状为
(2)实验室中可用KSCN或
 来检验
来检验 。
。 与KSCN溶液混合,可得到配位数为5的配合物的化学式是
与KSCN溶液混合,可得到配位数为5的配合物的化学式是(3)磷酸和亚磷酸(
 )是磷元素的两种含氧酸。
)是磷元素的两种含氧酸。 的空间构型为
的空间构型为 和
和 两种盐,则
两种盐,则 的结构简式为
的结构简式为(4)
 和
和 都是三角锥形分子,但键角
都是三角锥形分子,但键角 ,可能的原因是
,可能的原因是(5)氧化亚铁晶体的晶胞如图。已知:氧化亚铁晶体的密度为ρ g⋅cm
 ,
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与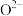 紧邻且等距离的
紧邻且等距离的 数目为
数目为 与
与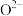 最短核间距为
最短核间距为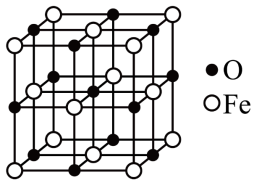
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】锂离子电池具有能量高、电压高、工作温度范围宽、贮存寿命长等优点。电池正极有磷酸铁锂(LiFePO4)、钛酸锂(Li2TiO3)、镍钴锰酸锂[Li(NiCoMn)O2]等。回答下列问题:
(1)基态Li原子的电子排布式为_______ ,基态Ti原子电子云轮廓图呈球形的能级上填充_______ 个电子。
(2)O和P电负性较大的是_______ (填元素符号),Fe、Co和Ni的第三电离能由大到小的顺序是_______ (用元素符号表示)。
(3)磷酸(H3PO4)的分子结构如图甲,其中P原子的杂化轨道类型是_______ 。浓磷酸呈粘稠状,且能与水任意比例混溶,从结构上分析磷酸具有这种的特性原因是_______ 。
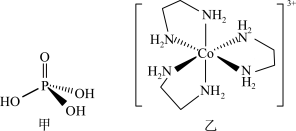
(4)Co的一种配离子如上图乙,该中心离子位于6个—NH2组成的_______ (填立体构型名称)中心位置,配离子中存在_______ 个 键。
键。
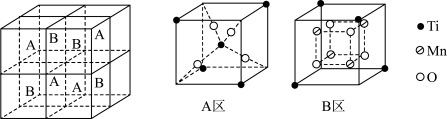
(5)钛锰复合氧化物的尖晶石晶胞由A区和B区组成,其结构如下图所示,该晶体中锰原子的配位数是_______ ,该晶体的化学式为_______ 。
(1)基态Li原子的电子排布式为
(2)O和P电负性较大的是
(3)磷酸(H3PO4)的分子结构如图甲,其中P原子的杂化轨道类型是

(4)Co的一种配离子如上图乙,该中心离子位于6个—NH2组成的
 键。
键。(5)钛锰复合氧化物的尖晶石晶胞由A区和B区组成,其结构如下图所示,该晶体中锰原子的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态 Fe2+的价电子排布式为_________ ,有 __________ 个未成对电子。
(2)氯化铝熔点为 194℃,而氧化铝熔点为 2050℃,二者熔点相差很大的原因是_________ 。
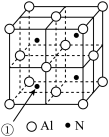
(3)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如下图所示: 晶胞中 Al 的配位数是_________ ,若该晶胞的边长为 a pm,则该晶体的密度为_________ g·cm−3。(用 N 表示阿伏加 德罗常数的值)
(4)一种铜的溴化物晶胞结构如下图所示:Cu 填充在 Br 的四面体空隙,则占据此类空隙的百分比为__________ ;该晶胞中铜的配位数是_________ ,与溴紧邻的溴原子数目是_________ ,由图中 P 点和 Q 点的原子坐标参数可确定 R 点的原子坐标参数为__________ 。

(1)基态 Fe2+的价电子排布式为
(2)氯化铝熔点为 194℃,而氧化铝熔点为 2050℃,二者熔点相差很大的原因是
(3)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如下图所示: 晶胞中 Al 的配位数是

(4)一种铜的溴化物晶胞结构如下图所示:Cu 填充在 Br 的四面体空隙,则占据此类空隙的百分比为

您最近一年使用:0次



