解题方法
1 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 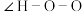 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: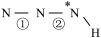 ,
, 为
为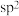 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
,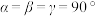 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
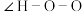 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: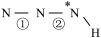 ,
, 为
为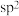 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为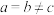 ,
,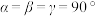 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
2 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的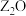 和黑色的
和黑色的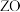 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。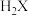 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)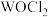 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向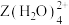 的溶液通入
的溶液通入 ,会生成
,会生成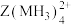 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的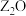 和黑色的
和黑色的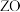 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是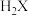 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
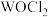 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
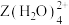 的溶液通入
的溶液通入 ,会生成
,会生成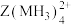 的原因是
的原因是
您最近半年使用:0次
名校
3 . 现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①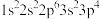 ②
②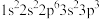 ③
③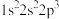 ④
④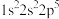
①
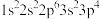 ②
②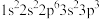 ③
③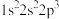 ④
④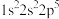
A.第一电离能:④ ③ ③ ② ② ① ① | B.原子半径:① ② ② ③ ③ ④ ④ |
C.未成对电子数:④ ③ ③ ② ② ① ① | D.电负性:④ ③ ③ ② ② ① ① |
您最近半年使用:0次
4 . 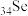 和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实不能 从元素的电负性角度解释的是
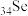 和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实A.熔点: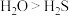 | B.还原性: |
C.沸点: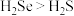 | D. 中H为+1价 中H为+1价 |
您最近半年使用:0次
2023-12-14更新
|
68次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 陈述Ⅰ和Ⅱ均正确﹐且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A. | 电负性:F>Cl | 酸性: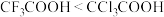 |
| B. | 分子极性: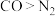 | 范德华力: |
| C. | 离子半径: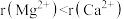 | 熔点:MgO>CaO |
| D. | 分子间作用力: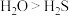 | 稳定性: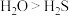 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-10-17更新
|
262次组卷
|
3卷引用:山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题
解题方法
6 . X、Y、Z为短周期主族元素,化合物 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是
 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是A.电负性: 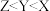 |
| B.基态Z原子和Y原子的未成对电子数相等 |
C. 的空间构型为三角锥形 的空间构型为三角锥形 |
D. 的分子中, 的分子中, 键与 键与 键个数比为2:1 键个数比为2:1 |
您最近半年使用:0次
2023-05-27更新
|
315次组卷
|
2卷引用:山东省潍坊市2023届高三下学期三模化学试题
名校
7 . 按照路易斯酸碱理论,在反应中接受电子对的物质为酸,在反应中给出电子对的物质为碱。酸可分为硬酸(半径小,电荷高)和软酸(半径大、电荷低),碱可以分为硬碱(给出电子对的原子电负性大)和软碱(给出电子对的原子电负性小)。软硬酸碱结合的原则是:软亲软,硬亲硬;软和硬,不稳定。下列微粒稳定性次序正确的是
A. | B. |
C.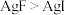 | D. |
您最近半年使用:0次
2023-05-18更新
|
331次组卷
|
3卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
解题方法
8 . 一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是
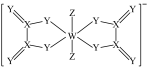

A.电负性: | B.简单氢化物的沸点: |
C.最高价氧化物对应水化物的酸性: | D.单质的氧化性: |
您最近半年使用:0次
名校
解题方法
9 . CuO在化学链(如气相烃类)燃烧和催化CO氧化过程中均展现出良好的性能,同时具有成本低廉的优势,有望成为贵金属催化剂的替代品。中国科学院工程热物理研究所的科研人员初步揭示了CO在CuO表面的催化机理,并深入研究了 在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
(1)基态铜原子的价电子排布式为___________ 。
(2)N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为___________ 。
(3)已知 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是___________ 。
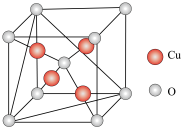
(4)铜的某种氧化物的晶胞结构如图所示,若该晶胞中 原子与O原子之间的最近距离为
原子与O原子之间的最近距离为 ,设阿伏加德罗常数的值为NA,则该晶胞的密度为
,设阿伏加德罗常数的值为NA,则该晶胞的密度为___________  (填含a、NA的代数式)。
(填含a、NA的代数式)。
 在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。(1)基态铜原子的价电子排布式为
(2)N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为
(3)已知
 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是(4)铜的某种氧化物的晶胞结构如图所示,若该晶胞中
 原子与O原子之间的最近距离为
原子与O原子之间的最近距离为 ,设阿伏加德罗常数的值为NA,则该晶胞的密度为
,设阿伏加德罗常数的值为NA,则该晶胞的密度为 (填含a、NA的代数式)。
(填含a、NA的代数式)。
您最近半年使用:0次
名校
10 . 化合物R是一种用于有机合成的催化剂,其网状结构片段如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素原子序数之和为29,W的第一电离能大于同周期相邻元素。下列说法正确的是
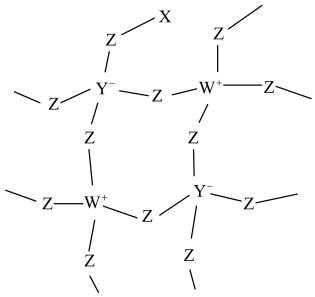

A.电负性: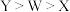 |
B.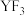 中各原子均满足8电子稳定结构 中各原子均满足8电子稳定结构 |
| C.同周期元素形成的单质中,Z的氧化性最强 |
D.化合物 中Y、Z、W原子的杂化类型相同 中Y、Z、W原子的杂化类型相同 |
您最近半年使用:0次



