1 . 现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
| A.第一电离能:④>③>②>① | B.原子半径:①>②>③>④ |
| C.未成对电子数:④>③=②>① | D.电负性:④>③>②>① |
您最近一年使用:0次
2024-03-15更新
|
198次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
2 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的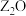 和黑色的
和黑色的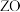 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。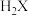 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)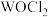 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向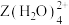 的溶液通入
的溶液通入 ,会生成
,会生成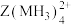 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的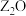 和黑色的
和黑色的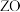 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是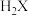 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
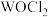 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
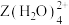 的溶液通入
的溶液通入 ,会生成
,会生成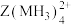 的原因是
的原因是
您最近一年使用:0次
3 .  和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实不能 从元素的电负性角度解释的是
 和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实A.熔点: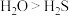 | B.还原性: |
C.沸点: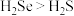 | D. 中H为+1价 中H为+1价 |
您最近一年使用:0次
2023-12-14更新
|
69次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 陈述Ⅰ和Ⅱ均正确﹐且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A. | 电负性:F>Cl | 酸性: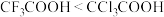 |
| B. | 分子极性: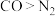 | 范德华力: |
| C. | 离子半径: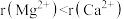 | 熔点:MgO>CaO |
| D. | 分子间作用力: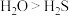 | 稳定性: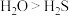 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-17更新
|
268次组卷
|
3卷引用:山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题
名校
5 . 按照路易斯酸碱理论,在反应中接受电子对的物质为酸,在反应中给出电子对的物质为碱。酸可分为硬酸(半径小,电荷高)和软酸(半径大、电荷低),碱可以分为硬碱(给出电子对的原子电负性大)和软碱(给出电子对的原子电负性小)。软硬酸碱结合的原则是:软亲软,硬亲硬;软和硬,不稳定。下列微粒稳定性次序正确的是
A. | B. |
C.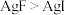 | D. |
您最近一年使用:0次
2023-05-18更新
|
340次组卷
|
3卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
6 . W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称_______ 。
(2)写出M元素+2价离子的价电子轨道表示式_______ 。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为_______ 。
(4)W、X、Z可形成强还原性物质 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(5)大π键可用符号 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作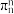 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键_______ ,某化合物XY的结构(见下图b)中也存在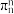 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因_______ 。

| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 核外只有一个未成对电子,且电子有三种空间运动状态 |
| Y | s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素 |
| Z | 电负性是短周期中最小的 |
| M | +3价基态离子最高能级处于半满状态 |
(1)写出X元素的名称
(2)写出M元素+2价离子的价电子轨道表示式
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为
(4)W、X、Z可形成强还原性物质
 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是(5)大π键可用符号
 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作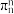 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键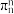 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
您最近一年使用:0次
2023-02-23更新
|
641次组卷
|
2卷引用:山东省潍坊市2022-2023学年高二上学期期末考试化学试题
7 . 绿柱石(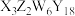 )是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,
)是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族, 和
和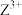 的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
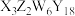 )是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,
)是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族, 和
和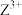 的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是| A.第一电离能:Z<W,第二电离能:Z>W |
| B.原子半径:Z>W>Y>X |
C.XY是碱性氧化物, 是酸性氧化物 是酸性氧化物 |
| D.已知W、Y都可与氢气生成氢化物,电负性Y>W>H |
您最近一年使用:0次
2022-12-27更新
|
593次组卷
|
4卷引用:山东省潍坊市2022年12月高三优生学习质量检测化学试题
8 . 回答下列问题:
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有_____ 。

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是_____ 。
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是____ 。
(4) 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为____ ;该物质中,含有σ键和π键数目之比为____ 。
(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成_____ 个σ键____ 个π键,在这些化学键中,O原子共提供了____ 个电子。
(6)乙腈(CH3CN)分子中碳原子的杂化类型有____ ,与N同周期的主族元素中,第一电离能大于N的有_____ 种,写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式_____ ,NO 离子的立体构型是
离子的立体构型是____ 。
(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第VIIB族。请写出基态Mn2+的价电子排布式:_____ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_____ 。
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是
(4)
 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成
(6)乙腈(CH3CN)分子中碳原子的杂化类型有
 互为等电子体的分子的化学式
互为等电子体的分子的化学式 离子的立体构型是
离子的立体构型是(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
名校
9 . 短周期元素原子组成的某种分子的结构式如图所示。X原子的核外电子只有一种运动状态;W、Y、Z位于同一周期,Z元素原子中p轨道所含电子数与s轨道相等。E与W有相同数目的价电子,下列说法正确的是
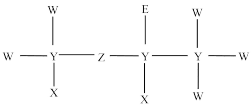

| A.电负性:X<Y<W |
| B.简单阴离子半径:W<Z<E |
| C.同周期中,第一电离能大于Z的元素有2种 |
| D.同主族元素中,E形成的气态氢化物最稳定 |
您最近一年使用:0次
2022-12-03更新
|
307次组卷
|
3卷引用:山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题
山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题山东省临沂市临沭第一中学2022-2023学年高三上学期11月月考化学试题(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(10-13)
解题方法
10 . 1932年美国化学家鲍林首先提出了电负性(用x表示)的概念。表中是某些短周期元素的x值:
(1)表格元素中,第一电离能最小的元素的基态原子电子排布式为____ 。
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。____
(3)第一电离能大小:Mg____ Al(填“大于”“小于”)。
(4)S元素和Cl元素基态原子核外未成对电子数之比为____ 。
(5)某有机化合物结构中含S-N键,其共用电子对偏向____ (写原子名称)。
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是____ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。
(3)第一电离能大小:Mg
(4)S元素和Cl元素基态原子核外未成对电子数之比为
(5)某有机化合物结构中含S-N键,其共用电子对偏向
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是
您最近一年使用:0次



