解题方法
1 . 氧和硫是元素周期表中第ⅥA族元素。下列说法正确的是
| A.电负性:O<S | B.沸点: |
C. 是极性分子 是极性分子 | D. 空间构型为平面三角形 空间构型为平面三角形 |
您最近一年使用:0次
解题方法
2 . 氢、氮、硫、氯、铜是元素周期表中前四周期元素。回答下列问题:
(1)氮在元素周期表中的位置_____ 。写出 的电子式
的电子式_____ , 的分子空间构型为
的分子空间构型为_____ , 中心原子的杂化方式为
中心原子的杂化方式为_____ 。
(2)氯与硫相比,非金属性较强的是_____ (用元素符号表示),下列事实能证明这一结论的是_____ (填序号)。
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性
c.酸性: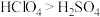 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性
(3)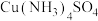 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是_____ (用元素符号表示); 中含有
中含有 键数目为
键数目为_____ 。
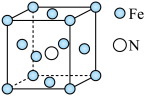
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为_____ ;设晶胞边长为 ,该晶体的密度为
,该晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
(1)氮在元素周期表中的位置
 的电子式
的电子式 的分子空间构型为
的分子空间构型为 中心原子的杂化方式为
中心原子的杂化方式为(2)氯与硫相比,非金属性较强的是
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性

c.酸性:
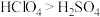 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性(3)
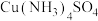 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是 中含有
中含有 键数目为
键数目为(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为
 ,该晶体的密度为
,该晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。
您最近一年使用:0次
解题方法
3 . 下列说法或解释错误的是
| A.C、N、O的电负性逐渐增大,其最简单氢化物分子中键角逐渐减小 |
B.可燃冰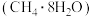 中甲烷分子与水分子间不会形成氢键 中甲烷分子与水分子间不会形成氢键 |
C.漂白粉溶液在空气中失效: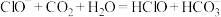 |
D.铜片在 和稀硫酸混合液中溶解: 和稀硫酸混合液中溶解: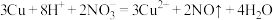 |
您最近一年使用:0次
名校
解题方法
4 . 2024年是元素周期表诞生的第155周年。已知短周期主族元素X、Y、Z、M、N,其原子序数与其对应的0.1mol/L最高价氧化物的水化物溶液,在常温下的pH关系如图所示。下列说法中正确的是

| A.X和Y元素均在p区 | B.元素的电负性:Z>M>N |
| C.M的含氧酸根离子的中心原子为sp2杂化 | D.XN3和ZN3的空间构型均为三角锥形 |
您最近一年使用:0次
2024-03-26更新
|
660次组卷
|
5卷引用:天津市耀华中学2024届高三下学期第一次模拟考试化学试卷
天津市耀华中学2024届高三下学期第一次模拟考试化学试卷2024届广东省大亚湾区普通高中毕业年级高三1月份联合模拟考试(一)化学试卷(已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(山东卷01)-2024年高考押题预测卷(已下线)压轴题05?“位-构-性”元素推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
5 . W、X、Y、Z、M、N六种元素的原子序数依次递增,其中W、X、Y、Z为短周期元素,六种元素的元素性质或原子结构特征如下表,回答下列问题。
(1)写出元素Z元素周期表中的位置___________ 。
(2)W、X、Y三种元素的电负性数值由大到小的顺序为___________ (用元素符号作答,下同),这三种元素的第一电离能由大到小的顺序为___________ 。
(3)写出元素M的价层电子排布式___________ 。
(4)写出元素N的N3+最外层电子排布式___________ 。
| 元素 | 元素性质或原子结构特征 |
| W | 原子p轨道的电子数为2 |
| X | 原子中最高能级的不同轨道都有电子,且自旋方向相同 |
| Y | 最外能层电子数是最内能层电子数的3倍 |
| Z | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素 |
| M | 第24号元素 |
| N | 一种常见的金属元素,正三价离子遇硫氰化钾显红色 |
(2)W、X、Y三种元素的电负性数值由大到小的顺序为
(3)写出元素M的价层电子排布式
(4)写出元素N的N3+最外层电子排布式
您最近一年使用:0次
2024-02-22更新
|
107次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
6 . 氮硼烷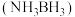 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子中电子占据最高能级的电子云轮廓图为_____ 形,基态N原子的电子排布式为_____ 。
(2)B的第一电离能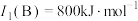 ,判断
,判断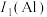
_____ 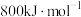 (填“
(填“ ”或“
”或“ ”)。
”)。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:
①电负性由大到小的顺序是_____ 。
②原子半径由大到小的顺序是_____ 。
③在元素周期表中的分区与其他两种不同的元素是_____ 。
(4)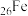 、
、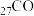 、
、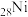 、
、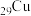 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
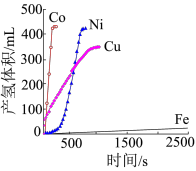
①催化效果最好的金属基态原子中未成对的电子数为_____ 。
②催化效果最差的金属基态原子的价层电子排布式为_____ 。
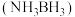 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)基态N原子中电子占据最高能级的电子云轮廓图为
(2)B的第一电离能
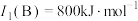 ,判断
,判断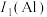
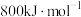 (填“
(填“ ”或“
”或“ ”)。
”)。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:①电负性由大到小的顺序是
②原子半径由大到小的顺序是
③在元素周期表中的分区与其他两种不同的元素是
(4)
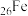 、
、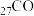 、
、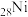 、
、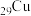 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为
②催化效果最差的金属基态原子的价层电子排布式为
您最近一年使用:0次
解题方法
7 . H、C、N、O、S、C1是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(1)H、C、O元素电负性由大到小的顺序为___________ 。
(2) 分子中
分子中 的杂化方式为
的杂化方式为___________ 杂化。
(3)基态硫原子的价层电子排布式___________ 。
(4)硫单质的一种结构为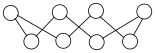 ,该物质
,该物质___________ (填“可溶”或“难溶”)于水。
(5)沸点:
___________  (填“>”或“<”),原因:
(填“>”或“<”),原因:___________ 。
(6)已知 的键能为
的键能为 的键能为
的键能为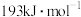 ,则
,则 分子中
分子中 键键能为
键键能为___________  。
。
(7) 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中 溶液的作用
溶液的作用___________ 。
②除掉 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是___________ 法。
(1)H、C、O元素电负性由大到小的顺序为
(2)
 分子中
分子中 的杂化方式为
的杂化方式为(3)基态硫原子的价层电子排布式
(4)硫单质的一种结构为
 ,该物质
,该物质(5)沸点:

 (填“>”或“<”),原因:
(填“>”或“<”),原因:(6)已知
 的键能为
的键能为 的键能为
的键能为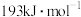 ,则
,则 分子中
分子中 键键能为
键键能为 。
。(7)
 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):| 危险性 |  |
| 储运要求 | 远离金属粉末、氮、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | 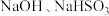 溶液吸收 溶液吸收 |
| 包装 | 钢瓶 |
 溶液的作用
溶液的作用②除掉
 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)某基态原子的价层电子的轨道表示式为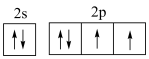
①s电子的电子云轮廓图是______________ 形
②有______________ 种空间运动状态不同的电子
③最外层有______________ 个电子
④有______________ 种能量不同的电子
(2)四种元素基态原子的电子排布式如下:①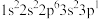 ;②
;② ;③
;③ ;④
;④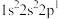
①第一电离能:①______________ ②(填“>”、“=”或“<”)
②电负性:③______________ ④(填“>”、“=”或“<”)
(1)某基态原子的价层电子的轨道表示式为

①s电子的电子云轮廓图是
②有
③最外层有
④有
(2)四种元素基态原子的电子排布式如下:①
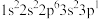 ;②
;② ;③
;③ ;④
;④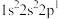
①第一电离能:①
②电负性:③
您最近一年使用:0次
解题方法
9 . 已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
(1)写出BA3的电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(3)实验室制备E的单质的离子反应方程式为___________ 。
(4)B和A中非金属性较强的是___________ (填元素的符号)。
(5)C与D的第一电离能大小为___________ 。
(6)G价电子排布图为___________ ,位于___________ 区。
(7)F元素的原子结构示意图为___________ ,前四周期中未成对电子数最多的元素在周期表中位置为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/molI2=1451kJ/mol I3=7733kJ/molI4=10540kJ/mol |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)实验室制备E的单质的离子反应方程式为
(4)B和A中非金属性较强的是
(5)C与D的第一电离能大小为
(6)G价电子排布图为
(7)F元素的原子结构示意图为
您最近一年使用:0次
10 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④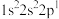 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④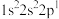 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近一年使用:0次
2024-01-24更新
|
141次组卷
|
7卷引用:天津市河北区2020-2021学年高二上学期期末检测化学试题



