解题方法
1 . 第三周期元素X、Y、Z的原子序数依次增大,25℃时,0.1mol/L它们最高价氧化物的水化物的溶液,对应的pH分别为13.00、1.57、0.70,下列有关说法正确的是
| A.原子半径:X<Y |
| B.元素电负性:Y<Z |
| C.Y的最高价氧化物的水化物属于强电解质 |
D.Z的最高价氧化物的水化物可能是 |
您最近一年使用:0次
名校
解题方法
2 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(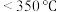 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(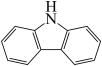 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(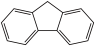 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
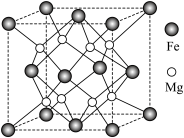
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(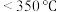 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
342次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
名校
解题方法
3 . 含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
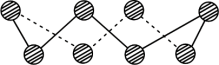
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
(3)Se的核外M层电子的排布式为_______ 。
(4)关于物质I~Ⅳ,下列说法正确的有_______ 。
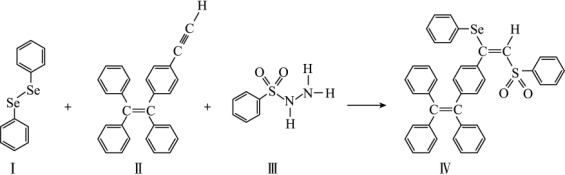
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是_______ 。
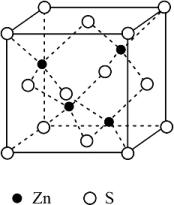
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为apm,密度为_______ gcm3(NA表示阿伏加德罗常数的值)。
(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)Se的核外M层电子的排布式为
(4)关于物质I~Ⅳ,下列说法正确的有

A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

您最近一年使用:0次
名校
4 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素G在周期表中的位置为_______ ,价电子排布式为_______ 。
(2)A、B、C三种元素的第一电离能由大到小为:_______ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为_______ 。
(4)D、E、F三种元素的电负性由大到小为:_______ 。
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为_______ 。阴极产物为_______
(6)工业上冶炼单质E的化学反应方程式_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)A、B、C三种元素的第一电离能由大到小为:
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为
(4)D、E、F三种元素的电负性由大到小为:
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为
(6)工业上冶炼单质E的化学反应方程式
您最近一年使用:0次
名校
5 . 用元素周期表中的部分元素及其化合物回答下列问题。
(1)C的基态原子的电子排布式_______ ;Zn在周期表中的位置是_______ 。
(2)C、N、O原子电负性由小到大顺序为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
(3) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ ,C原子的杂化方式为_______ , 分子为
分子为_______ 。(填“极性分子”或“非极性分子”)
(4)Au与NaCN溶液在 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:_______ 。
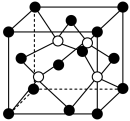
(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与 等距且最近的
等距且最近的 有
有_______ 个。已知该晶胞参数为dnm,晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
_______  。
。
(1)C的基态原子的电子排布式
(2)C、N、O原子电负性由小到大顺序为
 的空间构型为
的空间构型为(3)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为 分子为
分子为(4)Au与NaCN溶液在
 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与
 等距且最近的
等距且最近的 有
有 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
 。
。
您最近一年使用:0次
名校
6 . 下列说法正确的是
| A.电负性:Se>As | B.离子半径:Na+>Cl− |
| C.第一电离能:Al>Mg | D.键长:Cl−Cl>Br−Br |
您最近一年使用:0次
2022-01-07更新
|
485次组卷
|
6卷引用:天津市新华中学2022-2023学年高三上学期第二次月考化学试题
解题方法
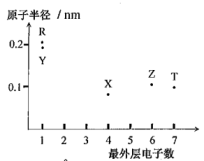
7 . 元素X、Y、Z、T、R的原子序数依次增大且小于20,其最外层电子数与原子半径间大大小关系如图所示。
请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:_______ 。
(2)上述五种元素中,电负性最大的是(写元素符号,下同)_______ ,第一电离能最小的是_______ 。
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)_______ 。
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为_______ 。
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:_______ 。通过观察现象得出的结论:相同条件下,同主族元素R的金属性比Y的强。
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:_______ 。欲观察到现象为:_______ ;结论:_______ 。

请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:
(2)上述五种元素中,电负性最大的是(写元素符号,下同)
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:
您最近一年使用:0次



