名校
解题方法
1 . W、X、Y、Z、M、N六种元素的原子序数依次递增,其中W、X、Y、Z为短周期元素,六种元素的元素性质或原子结构特征如下表,回答下列问题。
(1)写出元素Z元素周期表中的位置___________ 。
(2)W、X、Y三种元素的电负性数值由大到小的顺序为___________ (用元素符号作答,下同),这三种元素的第一电离能由大到小的顺序为___________ 。
(3)写出元素M的价层电子排布式___________ 。
(4)写出元素N的N3+最外层电子排布式___________ 。
| 元素 | 元素性质或原子结构特征 |
| W | 原子p轨道的电子数为2 |
| X | 原子中最高能级的不同轨道都有电子,且自旋方向相同 |
| Y | 最外能层电子数是最内能层电子数的3倍 |
| Z | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素 |
| M | 第24号元素 |
| N | 一种常见的金属元素,正三价离子遇硫氰化钾显红色 |
(2)W、X、Y三种元素的电负性数值由大到小的顺序为
(3)写出元素M的价层电子排布式
(4)写出元素N的N3+最外层电子排布式
您最近一年使用:0次
2024-02-22更新
|
107次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
2 . I.近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子简化的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的所在的原子轨道为_______ 形。与As位于同一周期,且未成对电子数也相同的元素有_______ (写元素符号)。
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为_______ ;BH 的空间构型为
的空间构型为_______ 。
(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为_______ 、_______ 。乙二胺能与Cu2+、Mg2+等金属离子形成稳定环状离子,其原因是_______ 。其中与乙二胺形成的化合物稳定性相对较高的是_______ (填Cu2+或Mg2+)。
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的_______ 区,Cu、Zn的第二电离能(I2):_______ >_______ 。
(5)下列状态的铜,电离最外层一个电子所需能量最大的是_______ 。
(6)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如图步骤完成实验:
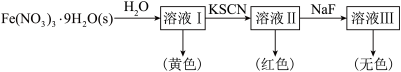
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有_______ molσ键;[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,其原因是_______ ,为了能观察到溶液I中[Fe(H2O)6]3+的浅紫色,可采取的方法是_______ 。
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,_______ 。
(1)基态砷原子简化的核外电子排布式为
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的
(5)下列状态的铜,电离最外层一个电子所需能量最大的是
| A.[Ar]3d104s1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104p1 |

已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,
您最近一年使用:0次
名校
3 . 胆矾CuSO4•5H2O可写[Cu(H2O)4]SO4•H2O,其结构示意图如图,下列有关胆矾的说法正确的是
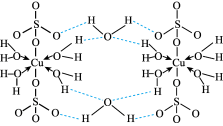

| A.所有氧原子都采取sp3杂化 |
| B.胆矾晶体中含有的粒子间的的作用有离子键、极性键、配位键、氢键4种化学键 |
| C.胆矾所含元素H、O、S的原子半径和电负性依次增大 |
| D.胆矾中的水在不同温度下会分步失去 |
您最近一年使用:0次
4 . 下列有关描述正确的是
A.键角:NH >H2S>H3O+ >H2S>H3O+ |
| B.酸性:CH3COOH<CH2ClCOOH<CHCl2COOH |
| C.电负性:Br>As>Se |
| D.沸点:CO<N2<HF |
您最近一年使用:0次
5 . 下列说法中,正确的是
| A.S区全部是金属元素 |
| B.第四周期元素中,未成对电子数最多的元素位于第VIB族 |
| C.第一电离能的大小可以作为判断元素金属性强弱的依据 |
| D.电负性大于1.8的一定是非金属,小于1.8的一定是金属 |
您最近一年使用:0次
真题
名校
6 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
10987次组卷
|
25卷引用:天津市耀华中学2023-2024学年高三上学期第一次月考化学试题
天津市耀华中学2023-2024学年高三上学期第一次月考化学试题2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题(已下线)FHgkyldyjhx12
名校
解题方法
7 . 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,X 核外电子只有 1 种运动状态,Y、W 的 2p 轨道均含有 2 个未成对电子,M 是与X 不同主族的金属元素,N 的氢氧化物具有两性,下列说法正确的是
| A.电负性:Z<Y<W |
| B.Y 的氢化物沸点不一定低于W 的氢化物 |
| C.第一电离能:M<N |
| D.N 的单质可以在高温下还原 M 的氧化物 |
您最近一年使用:0次
2023-01-06更新
|
622次组卷
|
5卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
8 . 回答下列问题:
(1)氟原子激发态的电子排布式有______ ,其中能量较高的是______ 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的______ 区,写出该基态原子电子排布式为______ 。
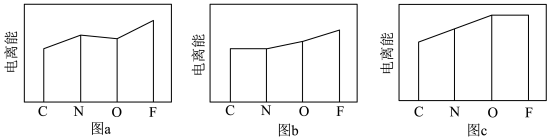
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______ (填标号),判断的根据是______ ;第三电离能的变化图是______ (填标号)。
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
①元素的电负性:Z______ W(填“大于”“小于”或“等于”)。
②简单离子半径:W______ Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______ Z(填“大于”“小于”或“等于”)。
(1)氟原子激发态的电子排布式有
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
②简单离子半径:W
③氢化物的稳定性:X
您最近一年使用:0次
2023-01-03更新
|
421次组卷
|
2卷引用:天津市和平区2022-2023学年高二上学期期末质量调查化学试卷
名校
解题方法
9 . 现有四种元素基态原子的电子排布式如下。则下列比较正确的是
①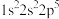 ;②
;② ;③
;③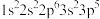 ;④
;④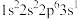
①
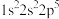 ;②
;② ;③
;③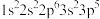 ;④
;④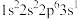
| A.第一电离能:③>①>④ | B.离子半径:④>①>② |
| C.电负性:①>②>④ | D.最高正化合价:①=③>④ |
您最近一年使用:0次
2022-09-02更新
|
685次组卷
|
7卷引用:天津市第一中学2020-2021学年高二下学期期中考试化学试题
10 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
2022-07-06更新
|
9289次组卷
|
28卷引用:天津市和平区2022-2023学年高二下学期期末质量调查化学试题
天津市和平区2022-2023学年高二下学期期末质量调查化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破吉林省长春市第五中学2022-2023学年高二上学期期末考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)(已下线)题型9 元素“位—构-性”关系的综合应用-高考必备50个题型(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题



