1 . 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
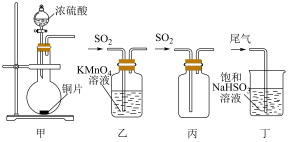
| A.用装置甲制取SO2 | B.用装置乙验证SO2的漂白性 |
| C.用装置丙收集SO2 | D.用装置丁处理实验中的尾气 |
您最近一年使用:0次
2024-03-25更新
|
1043次组卷
|
108卷引用:天津市第二十一中学2021-2022学年高一下学期期中学情调研化学试题
天津市第二十一中学2021-2022学年高一下学期期中学情调研化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试化学(江苏卷精编版)安徽省宣城市2016-2017学年高一下学期期末调研测试化学试题江苏省海安高级中学2018届高三1月月考化学试题北京市丰台区2018届高三上学期期末考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价重庆市第一中学2017-2018学年高一下学期第一次月考化学试题北京市密云区2017-2018学年高三第二学期阶段性练习理综化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省雅安中学2018-2019学年高一上学期开学考试化学试题山东省淄博市淄川中学2019届高三上学期开学考试化学试题【校级联考】湖北省宜昌县域高中协同发展共合体2018-2019学年高一上学期期末考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十二 化学实验基础知识重庆市璧山大路中学校2018-2019学年高一下学期4月月考化学试题重庆市第三十中学2018-2019学年高一下学期期中考试化学试题百所名校联考-非金属及其化合物福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题安徽省合肥二中2019-2020学年度高三上学期第一次段考化学试题安徽省芜湖市严桥中学2019-2020学年高三第一学期第三次月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题2019年秋高三化学复习强化练习—— 硫及其化合物上海市普陀区2020届高三上学期一模化学试题江苏省苏州市2018-2019学年高一上学期期末考试化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)专题3.4 硫及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》第2章 第3节 化学反应的利用福建省福州市第一中学2020年高一在线自测自评质检化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题4.3 硫及其化合物(讲)——2020年高考化学一轮复习讲练测北京市丰台区首师大附属云岗中学2019届高三上学期10月月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次调研考试化学试题(已下线)考点15 常见非金属元素单质及其重要化合物3——硫-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省珠海市2019-2020学年高一下学期期末学业质量监测化学试题苏教版(2020)高一必修第一册专题4 总结检测鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮高一必修第二册(人教2019版)第五章 素养检测高一必修第一册(苏教2019版)专题4 C 高考挑战区湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质3福建省漳州市平和县第一中学2021届高三上学期期中考试化学试题安徽省灵璧县第一中学2020-2021学年高一上学期12月月考试题山东省胶州市实验中学2020-2021学年高一上学期12月月考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)专题4 第一单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物宁夏银川一中2020-2021学年高一上学期期末考试(GAC)化学试题(已下线)5.1.3 不同价态含硫物质的转化(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)江苏省苏州市苏州大学附属中学2020-2021学年高一上学期月考化学试卷2湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题江苏省苏州市园区苏州大学附属中学2020-2021学年高一上学期12月月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题(已下线)【苏州新东方】04 吴县中学黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(A)试题吉林省白城一中、大安一中、通榆一中、洮南一中、镇赉一中2020-2021学年高一下学期期末考试化学试题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题江苏省昆山市周市高级中学2020-2021学年高一上学期第二次模块测试化学试题广东省深圳市第七高级中学2022届高三第一次月考化学试卷江苏省盐城市伍佑中学2021-2022学年高二上学期第一次阶段考试化学(必修)试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题江苏省徐州市沛县2021-2022学年高三上学期第一次学情调研化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题江苏省徐州市2021-2022学年高一上学期12月月考化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一上学期12月质量检测化学试题(已下线)第10练 硫及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)江苏省盐城市滨海县五汛中学2021-2022学年高二上学期期中考试化学试题甘肃省张掖市第二中学 2021-2022学年高一下学期3月月考化学试题宁夏青铜峡市高级中学2021-2022学年高一上学期期末考试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)上海市七宝中学 2021-2022学年高一下学期期中考试化学试题(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)江苏省南京市中华中学2021-2022学年高三上学期期中考试化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题江西省上饶市2019-2020学年高一下学期期末教学质量测试化学试题四川省资阳市乐至中学2022-2023学年高一下学期3月月考化学试题四川省自贡市荣县2022-2023学年高一下学期4月期中考试化学试题广东省广州市协和中学2022-2023学年高一下学期期中考试化学试题广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)山东省鄄城县第一中学2023-2024学年高三上学期9月月考化学试题(已下线)押题卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)福建省漳州市第一中学2023-2024学年高一上学期化学12月月考(第二单元)江西省丰城市东煌学校2022-2023学年高一下学期6月期末考试化学试题广东实验中学越秀学校2023-2024学年高一3月段考化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题(已下线)北京市西城区2024届高三下学期第三次模拟测试化学试题广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
21-22高一·全国·假期作业
名校
解题方法
2 . 一定条件下,当溶液中XO 与H2O2分子个数比恰好为2:5时,溶液中XO
与H2O2分子个数比恰好为2:5时,溶液中XO 离子被还原为较低价态,则X元素的化合价为
离子被还原为较低价态,则X元素的化合价为
 与H2O2分子个数比恰好为2:5时,溶液中XO
与H2O2分子个数比恰好为2:5时,溶液中XO 离子被还原为较低价态,则X元素的化合价为
离子被还原为较低价态,则X元素的化合价为| A.+2 | B.+3 | C.+4 | D.+5 |
您最近一年使用:0次
2024-02-26更新
|
107次组卷
|
11卷引用:天津市耀华中学2022-2023学年高一上学期期末考试化学试题
天津市耀华中学2022-2023学年高一上学期期末考试化学试题天津市耀华中学2022-2023学年高一上学期期末考试化学试题(已下线)第11讲 氧化还原反应的应用和配平-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第一章《物质及其变化》基础过关单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)河南省濮阳市油田一中2022-2023学年高一上学期月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 物质的量在化学方程式计算中的应用(一题多问)甘肃省天水市第一中学2023-2024学年高一上学期10月月考化学试题河北省石家庄市第十五中学2023-2024学年高一上学期第一次月考化学试题河北省石家庄市第一中学西校区2023-2024高一上学期期末考试化学试题河北省石家庄市西山学校2023-2024学年高一上学期期末考试化学试题
名校
3 . 完成下列问题
(1)H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
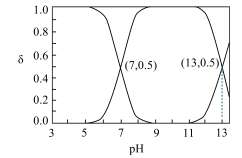
(2)H2S溶液中H2S、HS-、S2-含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图计算H2S的Ka2=___________ 。
(3)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
则该反应的△H=___________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A”或“B")。
(4)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
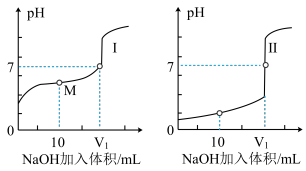
滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。V1和V2关系:V1_______ V2(填“>”“=”或“<”)。
(5)25℃时,amol/L的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为___________ 。(用含a的代数式表示)。
(1)H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
(2)H2S溶液中H2S、HS-、S2-含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图计算H2S的Ka2=

(3)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)已知上述反应中相关的化学键键能数据如下:
| 化学键 |  |  |  | 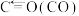 |
| 键能/ kJ∙mol-1 | 413 | 745 | 436 | 1075 |
(4)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

滴定醋酸的曲线是
(5)25℃时,amol/L的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为
您最近一年使用:0次
2024-02-22更新
|
65次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
4 . 回答下列问题
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为___________ ,电负性O___________ F;其中氧原子的杂化方式为___________ 。
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。 空间结构是
空间结构是___________ ;X与Z形成化合物中含有的化学键是___________ 。
(3) 的空间结构为
的空间结构为___________ 。(用文字描述,下同): 的空间结构是
的空间结构是___________ 。
(4)在BF3分子中: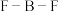 的键角是
的键角是___________ ,B原子的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4, 的空间结构为
的空间结构为___________ 。
(5)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ;其中π键与σ键的个数比为___________ 。
(7)基态S原子价电子排布式___________ ;S原子的核外电子运动状态有___________ 种,空间运动状态有___________ 种:能量最高的轨道的电子云的形状是___________ 。
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。
 空间结构是
空间结构是(3)
 的空间结构为
的空间结构为 的空间结构是
的空间结构是(4)在BF3分子中:
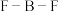 的键角是
的键角是 的空间结构为
的空间结构为(5)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为
(7)基态S原子价电子排布式
您最近一年使用:0次
2024-02-22更新
|
236次组卷
|
3卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . W、X、Y、Z、M、N六种元素的原子序数依次递增,其中W、X、Y、Z为短周期元素,六种元素的元素性质或原子结构特征如下表,回答下列问题。
(1)写出元素Z元素周期表中的位置___________ 。
(2)W、X、Y三种元素的电负性数值由大到小的顺序为___________ (用元素符号作答,下同),这三种元素的第一电离能由大到小的顺序为___________ 。
(3)写出元素M的价层电子排布式___________ 。
(4)写出元素N的N3+最外层电子排布式___________ 。
| 元素 | 元素性质或原子结构特征 |
| W | 原子p轨道的电子数为2 |
| X | 原子中最高能级的不同轨道都有电子,且自旋方向相同 |
| Y | 最外能层电子数是最内能层电子数的3倍 |
| Z | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素 |
| M | 第24号元素 |
| N | 一种常见的金属元素,正三价离子遇硫氰化钾显红色 |
(2)W、X、Y三种元素的电负性数值由大到小的顺序为
(3)写出元素M的价层电子排布式
(4)写出元素N的N3+最外层电子排布式
您最近一年使用:0次
2024-02-22更新
|
127次组卷
|
3卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
6 . 常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)= c(Cl-)+ c(ClO-)+ c(OH-) |
B.pH=5.2的NaHSO3溶液:c(Na+)>c( )>c(H2SO3)>c( )>c(H2SO3)>c( ) ) |
C. pH=11的氨水与pH=3的盐酸等体积混合;c(Cl-)= c( )>c(OH-)= c(H+) )>c(OH-)= c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)= c(CH3COO-)-c(CH3COOH) |
您最近一年使用:0次
2024-02-22更新
|
91次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . 分析下列反应,在任何温度下均能自发进行的是
A.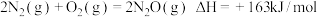 |
B.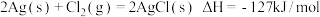 |
C.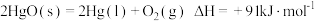 |
D.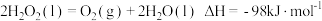 |
您最近一年使用:0次
名校
解题方法
8 . 为从粗食盐水中除去 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案:
 、
、 、
、 等离子,以制得精盐水,某同学设计如下方案:
等离子,以制得精盐水,某同学设计如下方案: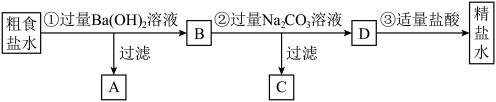
A. 中主要有 中主要有 和 和 ,也可能有一些 ,也可能有一些 |
B.②中加入过量 溶液的主要目的是为了除去 溶液的主要目的是为了除去 、 、 |
C. 中主要只有 中主要只有 、 、 、 、 这3种离子 这3种离子 |
D.③中发生的反应只有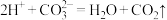 |
您最近一年使用:0次
2024-01-27更新
|
273次组卷
|
29卷引用:天津市和平区2022-2023学年高一上学期期末考试化学试题
天津市和平区2022-2023学年高一上学期期末考试化学试题北京市昌平区2019-2020学年高一上学期期末考试化学试题辽宁省营口市2020-2021学年高一上学期期末考试化学试题专题3 第三单元 海洋化学资源的综合利用-高中化学苏教2019版必修第一册北京市房山区2020-2021学年高一上学期期末考试化学试题河南省濮阳市油田第一中学2021年高一上学期第一次月考化学试题云南省昆明市第三中学2021-2022学年高一下学期期中考试化学试题江苏省盐城市2021-2022学年高一下学期期末考试化学试题湖北省武汉市第十一中学2022-2023学年高一上学期10月月考化学试题浙江省嘉善中学2022-2023学年高一上学期10月份检测化学试题四川省成都外国语学校2022-2023学年高一上学期期中考试化学试题北京市第二中学2022-2023学年高一上学期11月月考化学试题福建省厦门市第十中学2022-2023学年高一上学期期中考试化学试题陕西省西安市鄠邑区2022-2023学年高一下学期期中考试化学试题山西省实验中学2023-2024学年高一上学期第一次月考化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题福建省厦门市翔安第一中学2023-2024学年高三上学期10月月考化学试题福建省三明第一中学2023-2024学年高一上学期期中考试化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题福建省厦门市湖滨中学2023-2024学年高一上学期期中考试化学试题福建省福清西山学校2023-2024学年高一上学期12月月考化学试题福建省三明市五校2023-2024学年高一上学期期中联考化学试题湖南省衡阳市衡阳县2023-2024学年高一上学期1月期末考试化学试题黑龙江省鸡西市密山市2023-2024学年高二上学期9月月考化学试题四川省绵阳市三台中学2023-2024学年高一下学期3月月考化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题5.1.3 硫酸根离子检验、粗盐的提纯 随堂练习安徽省合肥市第一六八中2023-2024学年高一下学期期中考试化学试题
解题方法
9 . 下列说法正确的是
A.基态氧原子价电子排布图: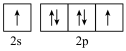 |
B.基态Cr原子电子排布式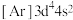 |
C. 的空间结构:平面三角形 的空间结构:平面三角形 |
D.冰中的氢键示意图: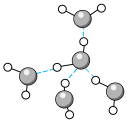 |
您最近一年使用:0次
解题方法
10 . 请回答下列问题:
Ⅰ.已知: 和HClO的电离平衡常数(25℃)如下:
和HClO的电离平衡常数(25℃)如下:
(1)相同物质的量浓度的 、
、 、NaClO溶液,pH由小到大的顺序是
、NaClO溶液,pH由小到大的顺序是___________ 。
(2)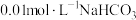 的溶液中
的溶液中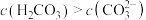 ,结合化学用语解释其原因:
,结合化学用语解释其原因:___________ 。
(3)请写出NaClO溶液中通入少量二氧化碳的离子方程式___________ 。
(4)盐碱地(含有较多的NaCl、 )不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因
)不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因___________ ,用石膏降低其碱性的反应原理___________ (用离子方程式及必要的文字说明)。
(5)根据酸碱质子理论,给出质子( )的物质是酸,给出质子的能力越强,酸性越强。已知:
)的物质是酸,给出质子的能力越强,酸性越强。已知: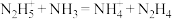 ,
, ,写出上述物质的酸性由强到弱的顺序
,写出上述物质的酸性由强到弱的顺序___________ 。
Ⅱ.在粗制 晶体中常含有杂质
晶体中常含有杂质 。在提纯时,为了除去
。在提纯时,为了除去 ,常加入少量
,常加入少量 ,使
,使 氧化为
氧化为 ,然后调节溶液pH=4,可以达到除去
,然后调节溶液pH=4,可以达到除去 而不损失的目的。
而不损失的目的。
(6)通过计算解释原因___________ (已知:①25℃时 饱和溶液中
饱和溶液中 。②25℃时
。②25℃时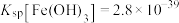 ,
,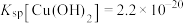 )。
)。
(7)计算过程:___________ 。
Ⅰ.已知:
 和HClO的电离平衡常数(25℃)如下:
和HClO的电离平衡常数(25℃)如下:| 化学式 |  | HClO |
电离平衡常数( ) ) |   |  |
 、
、 、NaClO溶液,pH由小到大的顺序是
、NaClO溶液,pH由小到大的顺序是(2)
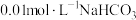 的溶液中
的溶液中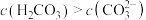 ,结合化学用语解释其原因:
,结合化学用语解释其原因:(3)请写出NaClO溶液中通入少量二氧化碳的离子方程式
(4)盐碱地(含有较多的NaCl、
 )不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因
)不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因(5)根据酸碱质子理论,给出质子(
 )的物质是酸,给出质子的能力越强,酸性越强。已知:
)的物质是酸,给出质子的能力越强,酸性越强。已知: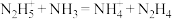 ,
, ,写出上述物质的酸性由强到弱的顺序
,写出上述物质的酸性由强到弱的顺序Ⅱ.在粗制
 晶体中常含有杂质
晶体中常含有杂质 。在提纯时,为了除去
。在提纯时,为了除去 ,常加入少量
,常加入少量 ,使
,使 氧化为
氧化为 ,然后调节溶液pH=4,可以达到除去
,然后调节溶液pH=4,可以达到除去 而不损失的目的。
而不损失的目的。(6)通过计算解释原因
 饱和溶液中
饱和溶液中 。②25℃时
。②25℃时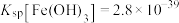 ,
,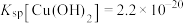 )。
)。(7)计算过程:
您最近一年使用:0次



