名校
解题方法
1 . 立德粉(主要成分为BaSO4 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:___________ 。
(2)加入H2O2发生反应的离子方程式为___________ 。
(3)分离出Fe(OH)3的实验操作名称为___________ 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去___________ (填离子符号),该反应的反应类型为___________ 。
(5)“滤渣”的成分是___________ 。
(6)8.34 g绿矾(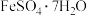 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: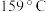 时固体N的化学式为
时固体N的化学式为___________ ,取适量  时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 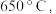 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式___________ 。
 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示: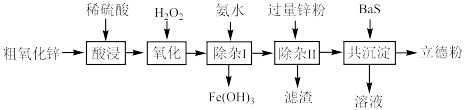
(2)加入H2O2发生反应的离子方程式为
(3)分离出Fe(OH)3的实验操作名称为
(4)“除杂Ⅱ”中加入过量的锌粉主要除去
(5)“滤渣”的成分是
(6)8.34 g绿矾(
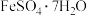 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: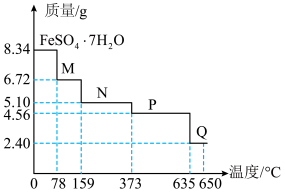
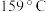 时固体N的化学式为
时固体N的化学式为 时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 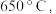 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
您最近一年使用:0次
2024-05-22更新
|
280次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
解题方法
2 . 下列化学用语或图示表达正确的是
A.Mg(OH)2的电子式: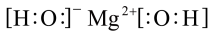 |
| B.第三周期所有元素中第一电离能比S大的元素只有Cl和Ar |
C.HCl的s-pσ键电子云图: |
D.Cu2+结构示意图: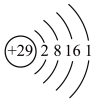 |
您最近一年使用:0次
解题方法
3 . 现有10种元素,其中X、Y、Z、A、E为短周期主族元素,原子序数依次增大;M、R、Q为第4周期元素。X元素原子的核外电子只有一种自旋取向;Y的基态原子核外2个能级上有电子,且每个能级上的电子数相等;Z原子核外有6种运动状态不同的电子。A元素原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素;E元素原子半径在同周期元素中最大;M是第四周期最外层只有一个电子的元素中原子序数最大的。R的3价阳离子遇KSCN溶液显红色。Q是ds区元素,基态原子核外7个能级上的电子均充满。请根据相关信息回答问题。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:___________ (填元素符号)。Y、Z、A、E四种元素原子半径由大到小的顺序:___________ (填元素符号)。
(2)R元素的基态原子的电子排布式___________ ,占据最高能级电子的电子云轮廓图为___________ 形。Q在周期表中位于第四周期第___________ 族。
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为___________ 。
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:___________ 。
(5)E在火焰上灼烧产生的黄光是一种___________ 光谱(填“发射”“吸收”)。
(6)从结构角度看,R2+易被氧化成R3+的原因是___________ 。
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+___________ (填“无”或“有”)颜色。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:
(2)R元素的基态原子的电子排布式
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:
(5)E在火焰上灼烧产生的黄光是一种
(6)从结构角度看,R2+易被氧化成R3+的原因是
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+
您最近一年使用:0次
解题方法
4 . 碳酸钛用作脱硫的催化剂,瓷釉、涂料和清漆的颜料,是合成二氧化锰和制造其他锰盐的原料。工业上制备高纯度碳酸锰的工艺流程如下:
②该工艺下,0.1mol/L的金属离子形成氢氧化物沉淀的pH如下:
③常温下,Ksp(CaF2)=1.60×10-10,Ksp(MgF2)=6.40×10-11.回答下列问题:
(1)基态Mn2+价电子的轨道表示式为___________ 。
(2)滤渣1的主要成份是:___________ ,其附着在矿粉颗粒表面会阻碍菱锰矿与酸的反应,若此时加入H2O2,利用其迅速分解产生的大量气泡可消除其不利影响,导致H2O2分解的因素是___________ 。
(3)在“浸出液”中加入“MnO2”所发生反应的离子方程式为___________ 。
(4)加入氨水调节溶液pH的范围___________ 。
(5)常温下,当溶液中Ca2+、Mg2+完全除去时,则c(F-)≥___________ mol/L。
(6)沉锰步骤发生主要反应的离子方程式为:___________ 。
(7)已知:5 +2Mn2++8H2O=16H++10
+2Mn2++8H2O=16H++10 +2
+2 ,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?___________ 。
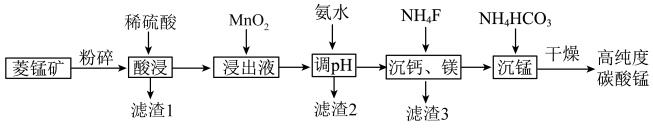
②该工艺下,0.1mol/L的金属离子形成氢氧化物沉淀的pH如下:
| 金属离子Mn+ | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.9 | 3.4 | 7.0 | 8.1 | 9.1 |
| 沉淀完全的pH[c(Mn2+)≤1.0×10-5mol/L] | 3.2 | 4.7 | 9.0 | 10.1 | 11.1 |
(1)基态Mn2+价电子的轨道表示式为
(2)滤渣1的主要成份是:
(3)在“浸出液”中加入“MnO2”所发生反应的离子方程式为
(4)加入氨水调节溶液pH的范围
(5)常温下,当溶液中Ca2+、Mg2+完全除去时,则c(F-)≥
(6)沉锰步骤发生主要反应的离子方程式为:
(7)已知:5
 +2Mn2++8H2O=16H++10
+2Mn2++8H2O=16H++10 +2
+2 ,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
您最近一年使用:0次
5 . 国家主席习近平提出了中国应对气候变化的两个目标:二氧化碳排放力争于2030年前达到峰值,于2060年前实现碳中和。杭州亚运会火炬使用的燃料为“零碳甲醇”,是利用焦炉气中的H2与从工业尾气中捕集的二氧化碳反应合成,实现废碳再生、循环内零碳排放。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。___________ 。
①该反应在___________ (填“高温”或“低温”)下能自发进行。
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是___________ 。
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/mol
ⅱ.CO(g)+2H2(g) CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol
ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为___________ 。
②反应ⅱ的平衡常数Kx=___________ (保留位小数)[对于反应aM(g)+bN(g) cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=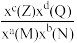 ,x为物质的量分数]。
,x为物质的量分数]。
(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[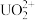 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:___________ 。
②阴极上可能发生副反应: +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=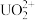 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是___________ 。
③电还原处理+6价的铀转移1rnole-,阴极区H+减少___________ mol(不考虑副反应)。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。

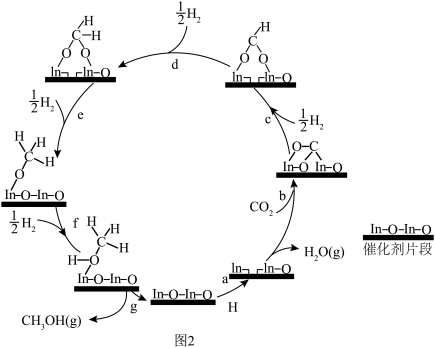
①该反应在
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/molⅱ.CO(g)+2H2(g)
 CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为
②反应ⅱ的平衡常数Kx=
 cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=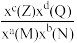 ,x为物质的量分数]。
,x为物质的量分数]。(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[
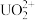 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示: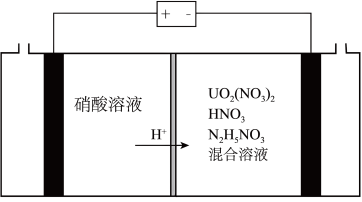
②阴极上可能发生副反应:
 +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=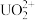 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是③电还原处理+6价的铀转移1rnole-,阴极区H+减少
您最近一年使用:0次
解题方法
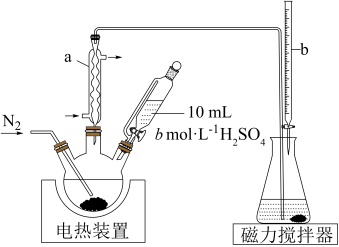
6 . 木耳营养丰富、有美容保健之功效。亚硫酸钠是食品加工厂中广泛使用的防腐剂和抗氧化剂,其在食品中的残留量通常以SO2含量计算。某化学实验小组为了检测木耳中亚硫酸钠的含量,设计实验如下:
回答下列问题:
(1)装置图中仪器b可选用___________ (填序号)。
A.酸式滴定管 B.碱式滴定管 C.聚四氟乙烯活塞滴定管
(2)使用恒压分液漏斗滴加硫酸的优点是___________ 。
(3)滴定管在使用前需要检验其是否漏水、水洗、___________ ;滴定终点时溶液的颜色为___________ 。
(4)滴定反应的离子方程式为___________ 。
(5)下列操作会使结果偏低的是___________ 。
a.滴定前滴定管尖嘴部分有气泡,滴定后消失
b.滴定终点读数时,仰视滴定管
c.实验时先加硫酸再通氮气
(6)实验中可将硫酸换成磷酸,理由是:___________ 。
(7)该样品中亚硫酸钠含量为___________ mg/kg(以SO2计,结果保留三位有效数字)。
回答下列问题:
(1)装置图中仪器b可选用
A.酸式滴定管 B.碱式滴定管 C.聚四氟乙烯活塞滴定管
(2)使用恒压分液漏斗滴加硫酸的优点是
(3)滴定管在使用前需要检验其是否漏水、水洗、
(4)滴定反应的离子方程式为
(5)下列操作会使结果偏低的是
a.滴定前滴定管尖嘴部分有气泡,滴定后消失
b.滴定终点读数时,仰视滴定管
c.实验时先加硫酸再通氮气
(6)实验中可将硫酸换成磷酸,理由是:
(7)该样品中亚硫酸钠含量为
您最近一年使用:0次
7 . 常温下,用0.2mol/L盐酸滴定25.00mL0.2mol/L某弱碱ROH溶液,所得溶液pH、R+和ROH的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是
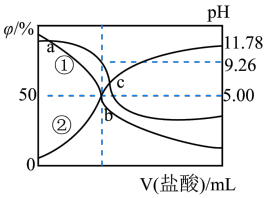

| A.曲线②代表ROH |
| B.若c点加入HCl溶液体积为25mL,则溶液中存在c(H+)>c(OH-)+c(ROH) |
| C.RCl的水解平衡常数为1.0×10-5 |
| D.a、b、c三点的溶液,水的电离程度:a<b<c |
您最近一年使用:0次
8 . 恒容密闭反应器中间有一个可自由移动的导热隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:甲:A(g)+B(g) 2C(g) △H>0、乙:X(g)+3Y(g)
2C(g) △H>0、乙:X(g)+3Y(g) 2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
 2C(g) △H>0、乙:X(g)+3Y(g)
2C(g) △H>0、乙:X(g)+3Y(g) 2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
| A.恒温条件下,向甲中通入C气体,再次平衡时,Z的物质的量浓度不变 |
| B.恒温条件下,向乙中通入惰性气体,再次平衡时,乙中Z的浓度减小 |
| C.绝热条件下,向乙中通入Z气体,A的平衡转化率不变 |
| D.绝热条件下,向甲中通入惰性气体,再次平衡时,C的物质的量不变 |
您最近一年使用:0次
9 . 由辉铜矿石(主要成分是Cu2S)制CuSO4的工作原理如图所示。下列说法不正确的是
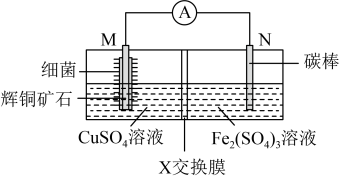

| A.N极为正极 |
| B.X交换膜为阴离子交换膜 |
C.M极上的电极反应式为:Cu2S+10e-+4H2O=2Cu2++8H++ |
| D.该电池工作时在某一温度范围内反应速率最快 |
您最近一年使用:0次
解题方法
10 . 常温下,下列各组离子在相应条件下可能大量共存的是
A.水电离出来的c(H+)<10-7mol/L的溶液中:Cl-、K+、 、S2- 、S2- |
B.遇甲基橙变红色的溶液中: 、Na+、Cl-、 、Na+、Cl-、 |
C.含Al3+的溶液中:K+、Na+、Cl-、 |
D.透明中性溶液中:Fe3+、 、 、 、Cl- 、Cl- |
您最近一年使用:0次



