1 . “结构决定性质”是化学学科的重要观念。下列性质差异与结构因素匹配错误 的是
| 选项 | 性质差异 | 结构因素 |
 | 对羟基苯甲醛的沸点高于邻羟基苯甲醛 | 前者存在氢键 |
 | 三氟乙酸的酸性大于三氯乙酸 | 氟的电负性大于氯的电负性 |
 | 苯酚( | 后者能形成分子内氢键 |
 | 在水溶液中的稳定性 强于 强于 |  轨道的电子数目 轨道的电子数目 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 回答下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________ 。
(2)①O2-、②Al3+、③Cl-、④Ca2+的半径由大到小排列为:___________ (用序号表示)。
(3)下列属于氧原子激发态的轨道表示式的有___________ (填字母)。
a.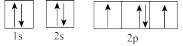 b.
b.
c.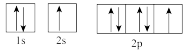 d.
d.
(4)Cu的价层电子排布式为___________ ,位于在周期表___________ 区(填s、p、d或ds)。
(5)基态Si原子中,电子占据的最高能层符号为___________ 。
(6)基态S原子的原子核外电子有___________ 种空间运动状态,其能量最高的电子电子云轮廓图为___________ 形。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①O2-、②Al3+、③Cl-、④Ca2+的半径由大到小排列为:
(3)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(4)Cu的价层电子排布式为
(5)基态Si原子中,电子占据的最高能层符号为
(6)基态S原子的原子核外电子有
您最近一年使用:0次
23-24高三上·江苏苏州·阶段练习
3 . 卤族元素包括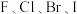 等,位于周期表VIIA族。卤族元素形成物质种类众多,磷可形成多种卤化物,其中固态
等,位于周期表VIIA族。卤族元素形成物质种类众多,磷可形成多种卤化物,其中固态 和
和 的结构分别是
的结构分别是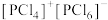 和
和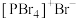 。溴化碘
。溴化碘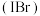 的化学性质与卤素相似。下列物质结构与性质或物质性质与用途具有对应关系的是
的化学性质与卤素相似。下列物质结构与性质或物质性质与用途具有对应关系的是
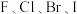 等,位于周期表VIIA族。卤族元素形成物质种类众多,磷可形成多种卤化物,其中固态
等,位于周期表VIIA族。卤族元素形成物质种类众多,磷可形成多种卤化物,其中固态 和
和 的结构分别是
的结构分别是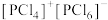 和
和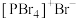 。溴化碘
。溴化碘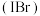 的化学性质与卤素相似。下列物质结构与性质或物质性质与用途具有对应关系的是
的化学性质与卤素相似。下列物质结构与性质或物质性质与用途具有对应关系的是| A.HF具有很强的吸湿性,可用于玻璃表面刻蚀花纹 |
B.液溴具有挥发性,可使用四氯化碳萃取溴水中的 |
C. 水溶液呈中性,可用于氯碱工业制取 水溶液呈中性,可用于氯碱工业制取 |
D.氟的电负性大于氯的电负性, 的酸性弱于 的酸性弱于 的酸性 的酸性 |
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中不正确 的是
 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中A.简单气态氢化物的热稳定性: | B.第一电离能: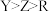 |
| C.Q在周期表的ds区 | D.电负性: |
您最近一年使用:0次
2023-12-23更新
|
536次组卷
|
3卷引用:广西钦州市第四中学2023-2024学年高二上学期12月考试化学试卷
2024·广西·模拟预测
名校
解题方法
5 . 氧化铈(CeO2)常用作玻璃工业添加剂,在其立方晶胞中掺杂Y2O3,Y3+占据原来Ce4+的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设CeO2晶胞边长为apm,下列说法错误的是
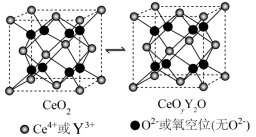

A.CeO2晶胞中 与最近 与最近 的核间距为 的核间距为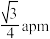 |
| B.CeO2立方晶胞中铈离子的配位数为4 |
| C.CeO2晶胞中氧离子填充在铈离子构成的四面体空隙中 |
| D.若掺杂Y2O3后得到n(CeO2)∶n(Y2O3)=0.8∶0.1的晶体,则此晶体中O2−的空缺率为5% |
您最近一年使用:0次
2024·广西·模拟预测
名校
6 . M、T、X、Y、Z为原子序数依次增加的短周期元素,其中M为周期表中原子半径最小的元素,T、X为同一周期且相邻,XM3的空间构型为三角锥形,Y是地壳中含量第三的元素,Z是同周期元素中原子半径最小的元素。下列说法正确的是
A.粒子键角:TM4>  | B.电负性:M<T<Z |
| C.XZ3和YZ3中Z的化合价相同 | D.XM4Z和YZ3形成的晶体类型相同 |
您最近一年使用:0次
7 .  (俗称铵铁蓝)是一种蓝色的无机颜料。下列有关该物质的说法错误的是
(俗称铵铁蓝)是一种蓝色的无机颜料。下列有关该物质的说法错误的是
 (俗称铵铁蓝)是一种蓝色的无机颜料。下列有关该物质的说法错误的是
(俗称铵铁蓝)是一种蓝色的无机颜料。下列有关该物质的说法错误的是A.电负性: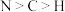 |
| B.铵铁蓝中铁元素有两种化合价 |
C. 中 中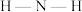 的键角比 的键角比 中的 中的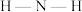 的键角大 的键角大 |
D.铵铁蓝中的配体是 ,该配体中 ,该配体中 键与 键与 键的数目之比是 键的数目之比是 |
您最近一年使用:0次
2023-10-29更新
|
1056次组卷
|
5卷引用:广西北海市2024届高三一模考试化学试题
广西北海市2024届高三一模考试化学试题甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线)热点17 分子结构与性质(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省德州市夏津县第一中学2023-2024学年高二下学期3月月考化学试题
8 . W、X、Y、Z是原子序数依次增大的短周期主族元素,其中Z元素基态原子L层电子数是电子层数的3倍。这四种元素组成的化合物(结构如图)可用于合成超分子聚合物。下列说法错误的是


| A.XZ2晶体属于共价晶体 | B.元素W、X、Y都可以与Z形成多种化合物 |
| C.电负性:Z>Y>X>W | D.超分子具有自组装和分子识别的特征 |
您最近一年使用:0次
2023-10-27更新
|
882次组卷
|
5卷引用:广西部分高中2024届高三第一次摸底测试化学试题
9 . 磷酸亚铁锂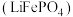 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用 、
、 、
、 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ ,基态P原子中未成对电子数为___________ ,N、O和P电负性由大到小的顺序是___________ 。
(2)下列Li原子轨道表示式表示的状态中,能量最高的是_______ (填标号)。
A. B.
B.
C. D.
D.
Li的第一电离能小于相邻元素Be的第一电离能,原因是_______ 。
(3)苯胺( )的晶体类型是
)的晶体类型是___________ , 苯胺中含有的
苯胺中含有的 键数目为
键数目为___________ 。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是_______ 。
(4)钴酸锂( )的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为___________ 。晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该钴酸锂晶体的密度可表示为
,该钴酸锂晶体的密度可表示为___________  (用含有
(用含有 的代数式表示)。
的代数式表示)。

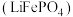 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用 、
、 、
、 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:(1)基态Fe原子的价电子排布式为
(2)下列Li原子轨道表示式表示的状态中,能量最高的是
A.
 B.
B.
C.
 D.
D.
Li的第一电离能小于相邻元素Be的第一电离能,原因是
(3)苯胺(
 )的晶体类型是
)的晶体类型是 苯胺中含有的
苯胺中含有的 键数目为
键数目为 )的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是(4)钴酸锂(
 )的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该钴酸锂晶体的密度可表示为
,该钴酸锂晶体的密度可表示为 (用含有
(用含有 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
10 . 尿素[CO(NH2)2]是一种重要的化工产品和常用氮肥。回答下列问题:
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是___________ (用元素符号表示)。
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):
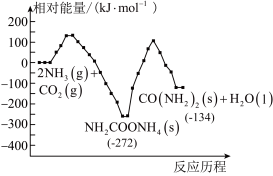
①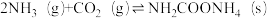
②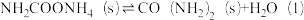
写出总反应的热化学方程式:___________ 。该历程中决速步骤的反应是___________ (填“①”或“②”)。
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
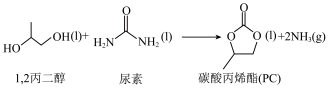 △H=+52kJ·mol-1
△H=+52kJ·mol-1
已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。( )
)
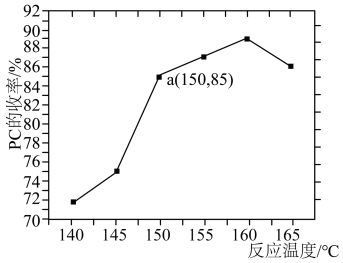
①160℃以上,PC的收率下降的主要原因可能是___________ 。
②150℃时,1,2-丙二醇的平衡转化率为___________ ;以液相中各物质的量分数代替浓度表示平衡常数Kx=___________ (列出计算式即可)。
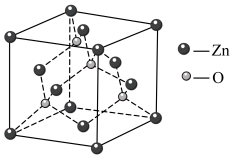
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为___________ ;已知晶胞参数为acm,该晶体的密度为___________ g·cm-3(写出计算式,阿佛加德罗常数的值为NA)。
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):

①
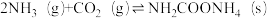
②
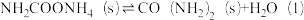
写出总反应的热化学方程式:
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
 △H=+52kJ·mol-1
△H=+52kJ·mol-1已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。(
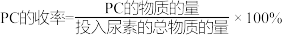 )
)
①160℃以上,PC的收率下降的主要原因可能是
②150℃时,1,2-丙二醇的平衡转化率为
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为

您最近一年使用:0次

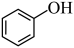 )的酸性比
)的酸性比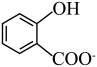 强
强

