名校
1 . 某有机物的结构简式如图所示,其中X和Y是第二周期两种相邻的非金属元素,Z元素基态原子的M能层上有3对成对电子。下列说法正确的是
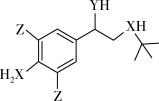

| A.原子半径:Z>Y>X |
| B.电负性:X<Y |
| C.Z的含氧酸酸性均强于碳酸 |
| D.Y氢化物的沸点低于X氢化物的沸点 |
您最近一年使用:0次
名校
2 . 短周期主族元素 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 元素的单质在自然界存在硬度很大的矿石,
元素的单质在自然界存在硬度很大的矿石, 原子最外层有
原子最外层有 个电子,
个电子, 元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,
元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质, 与
与 同主族。下列叙述正确的是
同主族。下列叙述正确的是
 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 元素的单质在自然界存在硬度很大的矿石,
元素的单质在自然界存在硬度很大的矿石, 原子最外层有
原子最外层有 个电子,
个电子, 元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质,
元素的氧化物可做耐高温材料且其最高价氧化物的水化物是难溶于水的碱性物质, 与
与 同主族。下列叙述正确的是
同主族。下列叙述正确的是A.原子最外层电子数由少到多的顺序: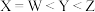 |
B.原子半径由大到小的顺序: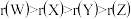 |
C.元素电负性由强到弱的顺序: |
D.元素的最简单气态氢化物的稳定性由强到弱的顺序: 、 、 、 、 |
您最近一年使用:0次
2022-03-10更新
|
225次组卷
|
2卷引用:天津市耀华中学2022届高三第二次模拟考化学试题
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是
| A.WX2分子为极性分子 |
| B.元素电负性:Z>W |
| C.原子半径:r(W)>r(Z)>r(Y) |
| D.最高价氧化物水化物的酸性:Z>W |
您最近一年使用:0次
2022-01-22更新
|
553次组卷
|
3卷引用:天津市和平区2022届高三一模化学试题
天津市和平区2022届高三一模化学试题江苏省苏北四市(徐州、淮安、宿迁、连云港)2021-2022学年高三上学期期末调研考试化学试题(已下线)押江苏卷第5题 物质结构与元素周期律 -备战2022年高考化学临考题号押题(江苏卷)
4 . 下列有关N、P及其化合物的说法错误的是
| A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 |
| B.N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 |
| C.NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 |
| D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低 |
您最近一年使用:0次
2021-10-09更新
|
8454次组卷
|
23卷引用:天津市和平区2021-2022学年高二下学期期末考试化学试题
天津市和平区2021-2022学年高二下学期期末考试化学试题天津市和平区2021-2022学年高二下学期期末样卷化学试题2021年新高考湖北化学高考真题2021年湖北高考化学试题变式题1-10(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题(已下线)专题八 物质结构与元素周期律-实战高考·二轮复习核心突破湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题(已下线)第3讲 化学键 共价键的类型及键参数(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 分子结构与性质广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题安徽省蚌埠市蚌埠铁路中学2023-2024学年高二下学期期中考试化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
真题
名校
5 . 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
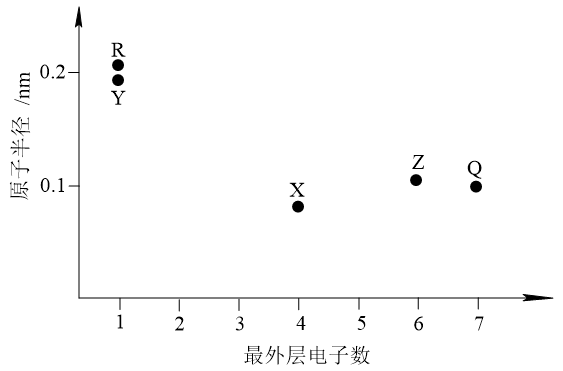

| A.X的电负性比Q的大 |
| B.Q的简单离子半径比R的大 |
| C.Z的简单气态氢化物的热稳定性比Q的强 |
| D.Y的最高价氧化物对应的水化物的碱性比R的强 |
您最近一年使用:0次
2021-09-07更新
|
6248次组卷
|
16卷引用:天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题
天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题2021年新高考天津化学高考真题湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题2021年天津高考化学试题变式题1-12(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)易错点14 元素周期表和元素周期律-备战2023年高考化学考试易错题福建省福州第十五中学2022-2023学年高三上学期11月线上限时训练化学试题(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律(已下线)题型10 元素“位—构—性”关系的综合应用广东番禺中学2022-2023学年高二下学期4月期中考试化学试题(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)广东省普宁市勤建学校2023-2024学年高三上学期第三次月考化学试题天津市南仓中学2023-2024学年高三上学期教学质量过程性检测与诊断化学试卷
13-14高二上·江苏泰州·期中
名校
解题方法
6 . 如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
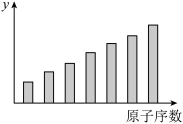
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
您最近一年使用:0次
2021-04-24更新
|
1003次组卷
|
51卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷湖北省蕲春县2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题山东省师范大学附属中学2017-2018学年高二下学期第七次学分认定考试(期中)(理)化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题山东省济宁市2018-2019学年高二期末模块检测化学试题宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题四川省南充市白塔中学2019-2020学年高二上学期期中考试化学试题人教化学选修3第一章第二节课时5福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题安徽省定远县育才学校2019-2020学年高一6月月考化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省建瓯市芝华中学2019-2020学年高二下学期第一次阶段考试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题福建省漳州市正兴学校等三校2021-2022学年高二下学期期中联考化学试题甘肃省兰州第一中学2021-2022学年高二下学期期中考试化学试题福建省宁德市柘荣县第一中学2021-2022学年高二下学期月考八化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题河北省石家庄市第二十七中学2022-2023学年高三上学期九月月考化学试题新疆疏勒县实验学校2021-2022学年高二下学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题重庆市缙云教育联盟2022-2023学年高二上学期期末联考化学试题黑龙江省大庆市大庆中学2022-2023学年高二下学期4月月考化学试题新疆维吾尔自治区皮山县高级中学2022-2023学年高二下学期4月期中化学试题福建省南平市浦城县2022-2023学年高二下学期期中考试化学试题重庆市2022-2023学年高二上学期期末考试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)天津市九十六中学2023-2024学年高三上学期12月月考化学试题四川省阆中中学校2023-2024学年高二下学期4月期中化学试题(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
7 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
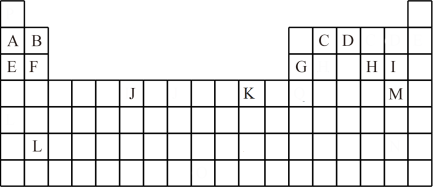
试回答下列问题:
(1)写出基态 原子的电子排布式:
原子的电子排布式:_______ , 的原子序数:
的原子序数:_______ , 的简化电子排布式:
的简化电子排布式:_______ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是_______ (填选项字母)。
A. 位于元素周期表中第四周期第ⅡB族,属于
位于元素周期表中第四周期第ⅡB族,属于 区元素
区元素
B. 位于元素周期表中第四周期第ⅣB族,属于
位于元素周期表中第四周期第ⅣB族,属于 区元素
区元素
C. 位于元素周期表中第三周期第ⅡA族,属于
位于元素周期表中第三周期第ⅡA族,属于 区元素
区元素
D. 位于元素周期表中第三周期第ⅦA族,属于
位于元素周期表中第三周期第ⅦA族,属于 区元素
区元素
(3)下列有关说法正确的是_______ (填选项字母)。
A.第一电离能:G>F>E B.电负性:D>C C.原子半径:B>E D.最高价含氧酸的酸性:I>H

试回答下列问题:
(1)写出基态
 原子的电子排布式:
原子的电子排布式: 的原子序数:
的原子序数: 的简化电子排布式:
的简化电子排布式:(2)下列关于元素在元素周期表中的位置的叙述正确的是
A.
 位于元素周期表中第四周期第ⅡB族,属于
位于元素周期表中第四周期第ⅡB族,属于 区元素
区元素B.
 位于元素周期表中第四周期第ⅣB族,属于
位于元素周期表中第四周期第ⅣB族,属于 区元素
区元素C.
 位于元素周期表中第三周期第ⅡA族,属于
位于元素周期表中第三周期第ⅡA族,属于 区元素
区元素D.
 位于元素周期表中第三周期第ⅦA族,属于
位于元素周期表中第三周期第ⅦA族,属于 区元素
区元素(3)下列有关说法正确的是
A.第一电离能:G>F>E B.电负性:D>C C.原子半径:B>E D.最高价含氧酸的酸性:I>H
您最近一年使用:0次
2021-01-19更新
|
1129次组卷
|
4卷引用:天津市耀华中学2020-2021学年高二上学期期末考试化学试题
天津市耀华中学2020-2021学年高二上学期期末考试化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)第一章原子结构与性质(提升卷)
8 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
2020-07-11更新
|
8530次组卷
|
45卷引用:天津市耀华中学2023-2024学年度高三上学期开学检测化学试题
天津市耀华中学2023-2024学年度高三上学期开学检测化学试题2020年天津卷化学高考试题(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(人教版2019)选择性必修2 第一章 原子结构与性质 章末综合检测卷(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2020年天津卷化学高考真题变式题1-12湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州第一中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型80 用表格承载信息考查元素周期律(已下线)第五章 物质结构与性质元素周期律 第27练 元素周期表和元素周期律北京市第八十中学2023届高三下学期二模适应考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)第2讲 元素素周期表 元素周期律天津市红桥区2023-2024学年高三上学期期中考试化学试题河北省保定市唐县第一中学2023-2024学年高二上学期12月期中考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题云南省保山市腾冲市第八中学2024届高三上学期期末模拟考试化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题北京市第十四中学2023-2024学年高三下学期三模化学试题
名校
9 . 如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
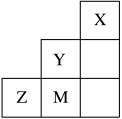

| A.电负性:Z>M>Y |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子轨道表示式为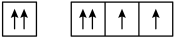 |
您最近一年使用:0次
2020-05-06更新
|
414次组卷
|
9卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】四川省成都外国语学校2019-2020学年高二下学期开学考试化学试题四川省邛崃市高埂中学2019-2020学年度高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题
名校
解题方法
10 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________ ,磷的基态原子的价电子排布式为__________ ,六种元素中电负性最大的是__________ (填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________ 。NH3的分子构型为__________ ,中心原子的杂化方式为__________ 。
(3)热稳定性:NH3_____ PH3(填“>”或“<”),沸点:N2H4______ P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________ 。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________ 。
(1)砷(As)在元素周期表中的位置为
(2)N2分子中σ键和π键的数目比N(σ): N(π)=
(3)热稳定性:NH3
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入
您最近一年使用:0次



