名校
解题方法
1 . 2024年是元素周期表诞生的第155周年。已知短周期主族元素X、Y、Z、M、N,其原子序数与其对应的0.1mol/L最高价氧化物的水化物溶液,在常温下的pH关系如图所示。下列说法中正确的是

| A.X和Y元素均在p区 | B.元素的电负性:Z>M>N |
| C.M的含氧酸根离子的中心原子为sp2杂化 | D.XN3和ZN3的空间构型均为三角锥形 |
您最近一年使用:0次
2024-03-26更新
|
661次组卷
|
5卷引用:天津市耀华中学2024届高三下学期第一次模拟考试化学试卷
天津市耀华中学2024届高三下学期第一次模拟考试化学试卷2024届广东省大亚湾区普通高中毕业年级高三1月份联合模拟考试(一)化学试卷(已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(山东卷01)-2024年高考押题预测卷(已下线)压轴题05?“位-构-性”元素推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
2 . H、C、N、O、S、C1是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(1)H、C、O元素电负性由大到小的顺序为___________ 。
(2) 分子中
分子中 的杂化方式为
的杂化方式为___________ 杂化。
(3)基态硫原子的价层电子排布式___________ 。
(4)硫单质的一种结构为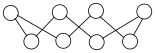 ,该物质
,该物质___________ (填“可溶”或“难溶”)于水。
(5)沸点:
___________  (填“>”或“<”),原因:
(填“>”或“<”),原因:___________ 。
(6)已知 的键能为
的键能为 的键能为
的键能为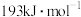 ,则
,则 分子中
分子中 键键能为
键键能为___________  。
。
(7) 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中 溶液的作用
溶液的作用___________ 。
②除掉 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是___________ 法。
(1)H、C、O元素电负性由大到小的顺序为
(2)
 分子中
分子中 的杂化方式为
的杂化方式为(3)基态硫原子的价层电子排布式
(4)硫单质的一种结构为
 ,该物质
,该物质(5)沸点:

 (填“>”或“<”),原因:
(填“>”或“<”),原因:(6)已知
 的键能为
的键能为 的键能为
的键能为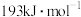 ,则
,则 分子中
分子中 键键能为
键键能为 。
。(7)
 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):| 危险性 |  |
| 储运要求 | 远离金属粉末、氮、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | 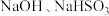 溶液吸收 溶液吸收 |
| 包装 | 钢瓶 |
 溶液的作用
溶液的作用②除掉
 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是
您最近一年使用:0次
名校
解题方法
3 . I.近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子简化的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的所在的原子轨道为_______ 形。与As位于同一周期,且未成对电子数也相同的元素有_______ (写元素符号)。
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为_______ ;BH 的空间构型为
的空间构型为_______ 。
(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为_______ 、_______ 。乙二胺能与Cu2+、Mg2+等金属离子形成稳定环状离子,其原因是_______ 。其中与乙二胺形成的化合物稳定性相对较高的是_______ (填Cu2+或Mg2+)。
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的_______ 区,Cu、Zn的第二电离能(I2):_______ >_______ 。
(5)下列状态的铜,电离最外层一个电子所需能量最大的是_______ 。
(6)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如图步骤完成实验:
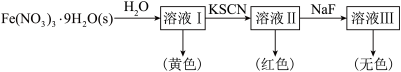
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有_______ molσ键;[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,其原因是_______ ,为了能观察到溶液I中[Fe(H2O)6]3+的浅紫色,可采取的方法是_______ 。
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,_______ 。
(1)基态砷原子简化的核外电子排布式为
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的
(5)下列状态的铜,电离最外层一个电子所需能量最大的是
| A.[Ar]3d104s1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104p1 |

已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,
您最近一年使用:0次
真题
名校
4 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
10995次组卷
|
25卷引用:天津市耀华中学2023-2024学年高三上学期第一次月考化学试题
天津市耀华中学2023-2024学年高三上学期第一次月考化学试题2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题(已下线)FHgkyldyjhx12
2023·全国·模拟预测
名校
解题方法
5 . 六方氮化硼(BN)被称为“白色石墨烯”,其纳米片可用于以乙烯-乙酸乙烯酯共聚物为基体的导热复合材料中。下列有关说法正确的是
| A.基态N原子中有2个未成对电子 | B.石墨烯中碳原子的杂化方式为 杂化 杂化 |
C.乙烯分子中 键和 键和 键个数之比为4∶1 键个数之比为4∶1 | D.BN中N的化合价为 价 价 |
您最近一年使用:0次
名校
6 . 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是
| A.N元素基态原子所有价电子的电子云轮廓图均为哑铃形 |
| B.Se元素基态原子的电子排布式为[Ar]4s24p4 |
| C.O、F、Cl电负性由大到小的顺序为F>Cl>O |
| D.第一电离能As>Se |
您最近一年使用:0次
2023-03-24更新
|
542次组卷
|
4卷引用:天津市武清区杨村第一中学2023-2024学年高三上学期第三次质量检测化学试题
7 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
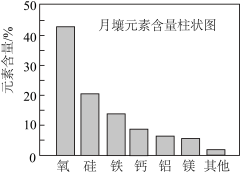
| A.原子半径:Al<Si | B.第一电离能:Mg<Ca |
| C.Fe位于元素周期表的p区 | D.这六种元素中,电负性最大的是O |
您最近一年使用:0次
2023-02-23更新
|
3965次组卷
|
17卷引用:天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题
天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(选择题1-4)天津市第二南开学校2022--2023学年高二下学期期中质量调查化学试题天津市北辰区2023-2024学年高三上学期11月期中考试化学试题(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第19讲元素周期律与元素周期表黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题1-5(已下线)专题11 原子结构 原子结构与元素的性质-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)湖南省长沙市明德中学2023-2024学年高二上学期12月月考化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题(已下线)热点02 原子结构与元素的性质广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
名校
8 . 有关周期表和周期律的说法正确的是
| A.周期表p区所有元素,电子最后填入的能级均为p能级 |
| B.第二周期元素,电离能介于B和N之间的元素有1种 |
| C.周期表第14列元素形成化合物种类最多 |
| D.同一周期,第ⅡA族元素电负性大于第ⅢA族元素 |
您最近一年使用:0次
2023-02-11更新
|
711次组卷
|
9卷引用:天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题
天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题山东省济宁市2022-2023学年高二上学期期末考试化学试题山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题广东番禺中学2022-2023学年高二下学期4月期中考试化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷湖北省荆州市沙市中学2022-2023学年高二下学期2月月考化学试题
9 . 回答下列问题:
(1)氟原子激发态的电子排布式有______ ,其中能量较高的是______ 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的______ 区,写出该基态原子电子排布式为______ 。
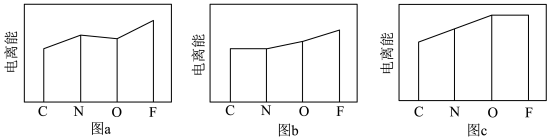
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______ (填标号),判断的根据是______ ;第三电离能的变化图是______ (填标号)。
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
①元素的电负性:Z______ W(填“大于”“小于”或“等于”)。
②简单离子半径:W______ Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______ Z(填“大于”“小于”或“等于”)。
(1)氟原子激发态的电子排布式有
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
②简单离子半径:W
③氢化物的稳定性:X
您最近一年使用:0次
2023-01-03更新
|
421次组卷
|
2卷引用:天津市和平区2022-2023学年高二上学期期末质量调查化学试卷
真题
名校
10 . 工业上电解熔融 和冰晶石
和冰晶石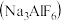 的混合物可制得铝。下列说法正确的是
的混合物可制得铝。下列说法正确的是
 和冰晶石
和冰晶石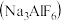 的混合物可制得铝。下列说法正确的是
的混合物可制得铝。下列说法正确的是A.半径大小: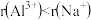 | B.电负性大小: |
C.电离能大小: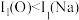 | D.碱性强弱: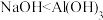 |
您最近一年使用:0次
2022-07-21更新
|
8745次组卷
|
30卷引用:天津市第四中学2023-2024学年高三上学期第二次月考化学试卷
天津市第四中学2023-2024学年高三上学期第二次月考化学试卷(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题1-13江苏省马坝高级中学2022-2023学年高三上学期第一次检测化学试题江苏省宿迁市泗阳县实验高级中学2022-2023学年高二上学期第一次调研测试化学试题(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)易错点14 元素周期表和元素周期律-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)【知识图鉴】单元讲练测选择性必修2第1章03巩固练(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题1-5)(已下线)专题卷20 《物质结构与性质》选择题分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)安徽省合肥市第一中学2022-2023学年高二下学期期中考试化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题(已下线)第2讲 元素素周期表 元素周期律(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省泗阳县实验高级中学2023-2024学年高二上学期第一次调研测试化学试题河南省许昌市建安区第一高级中学2023-2024学年高二上学期12月月考化学试题河南省濮阳市第一高级中学2023-2024学年高二下学期第一次月考化学(B)试题江苏省扬州市第一中学2023-2024学年高二下学期期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二下学期4月月考化学试题广东省惠州市华罗庚中学2023-2024学年高二下学期3月月考化学试题江苏省扬州市红桥高级中学2023-2024学年高二下学期4月期中考试化学(选修)试题



