解题方法
1 . 氢、氮、硫、氯、铜是元素周期表中前四周期元素。回答下列问题:
(1)氮在元素周期表中的位置_____ 。写出 的电子式
的电子式_____ , 的分子空间构型为
的分子空间构型为_____ , 中心原子的杂化方式为
中心原子的杂化方式为_____ 。
(2)氯与硫相比,非金属性较强的是_____ (用元素符号表示),下列事实能证明这一结论的是_____ (填序号)。
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性
c.酸性: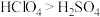 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性
(3)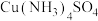 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是_____ (用元素符号表示); 中含有
中含有 键数目为
键数目为_____ 。
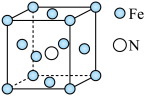
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为_____ ;设晶胞边长为 ,该晶体的密度为
,该晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
(1)氮在元素周期表中的位置
 的电子式
的电子式 的分子空间构型为
的分子空间构型为 中心原子的杂化方式为
中心原子的杂化方式为(2)氯与硫相比,非金属性较强的是
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性

c.酸性:
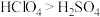 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性(3)
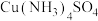 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是 中含有
中含有 键数目为
键数目为(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为
 ,该晶体的密度为
,该晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
2 . W、X、Y、Z、M、N六种元素的原子序数依次递增,其中W、X、Y、Z为短周期元素,六种元素的元素性质或原子结构特征如下表,回答下列问题。
(1)写出元素Z元素周期表中的位置___________ 。
(2)W、X、Y三种元素的电负性数值由大到小的顺序为___________ (用元素符号作答,下同),这三种元素的第一电离能由大到小的顺序为___________ 。
(3)写出元素M的价层电子排布式___________ 。
(4)写出元素N的N3+最外层电子排布式___________ 。
| 元素 | 元素性质或原子结构特征 |
| W | 原子p轨道的电子数为2 |
| X | 原子中最高能级的不同轨道都有电子,且自旋方向相同 |
| Y | 最外能层电子数是最内能层电子数的3倍 |
| Z | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素 |
| M | 第24号元素 |
| N | 一种常见的金属元素,正三价离子遇硫氰化钾显红色 |
(2)W、X、Y三种元素的电负性数值由大到小的顺序为
(3)写出元素M的价层电子排布式
(4)写出元素N的N3+最外层电子排布式
您最近一年使用:0次
2024-02-22更新
|
107次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
3 . 氮硼烷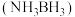 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子中电子占据最高能级的电子云轮廓图为_____ 形,基态N原子的电子排布式为_____ 。
(2)B的第一电离能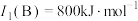 ,判断
,判断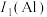
_____ 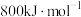 (填“
(填“ ”或“
”或“ ”)。
”)。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:
①电负性由大到小的顺序是_____ 。
②原子半径由大到小的顺序是_____ 。
③在元素周期表中的分区与其他两种不同的元素是_____ 。
(4)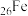 、
、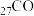 、
、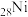 、
、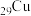 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
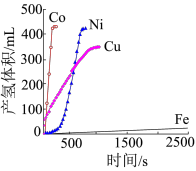
①催化效果最好的金属基态原子中未成对的电子数为_____ 。
②催化效果最差的金属基态原子的价层电子排布式为_____ 。
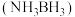 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)基态N原子中电子占据最高能级的电子云轮廓图为
(2)B的第一电离能
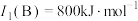 ,判断
,判断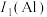
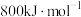 (填“
(填“ ”或“
”或“ ”)。
”)。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:
。在H、B、N三种元素中:①电负性由大到小的顺序是
②原子半径由大到小的顺序是
③在元素周期表中的分区与其他两种不同的元素是
(4)
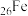 、
、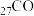 、
、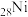 、
、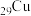 是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
是目前氨硼烷水解产氢催化剂研究的热点。不同催化剂催化氨硼烷水解产氢的性能如图所示。这四种催化剂中:
①催化效果最好的金属基态原子中未成对的电子数为
②催化效果最差的金属基态原子的价层电子排布式为
您最近一年使用:0次
解题方法
4 . H、C、N、O、S、C1是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(1)H、C、O元素电负性由大到小的顺序为___________ 。
(2) 分子中
分子中 的杂化方式为
的杂化方式为___________ 杂化。
(3)基态硫原子的价层电子排布式___________ 。
(4)硫单质的一种结构为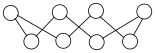 ,该物质
,该物质___________ (填“可溶”或“难溶”)于水。
(5)沸点:
___________  (填“>”或“<”),原因:
(填“>”或“<”),原因:___________ 。
(6)已知 的键能为
的键能为 的键能为
的键能为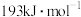 ,则
,则 分子中
分子中 键键能为
键键能为___________  。
。
(7) 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中 溶液的作用
溶液的作用___________ 。
②除掉 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是___________ 法。
(1)H、C、O元素电负性由大到小的顺序为
(2)
 分子中
分子中 的杂化方式为
的杂化方式为(3)基态硫原子的价层电子排布式
(4)硫单质的一种结构为
 ,该物质
,该物质(5)沸点:

 (填“>”或“<”),原因:
(填“>”或“<”),原因:(6)已知
 的键能为
的键能为 的键能为
的键能为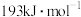 ,则
,则 分子中
分子中 键键能为
键键能为 。
。(7)
 是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
是一种大气污染物,液氯储存区贴有的说明卡如下(部分):| 危险性 |  |
| 储运要求 | 远离金属粉末、氮、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | 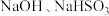 溶液吸收 溶液吸收 |
| 包装 | 钢瓶 |
 溶液的作用
溶液的作用②除掉
 中的
中的 通过饱和食盐水,这种操作方法是
通过饱和食盐水,这种操作方法是
您最近一年使用:0次
解题方法
5 . 已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
(1)写出BA3的电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(3)实验室制备E的单质的离子反应方程式为___________ 。
(4)B和A中非金属性较强的是___________ (填元素的符号)。
(5)C与D的第一电离能大小为___________ 。
(6)G价电子排布图为___________ ,位于___________ 区。
(7)F元素的原子结构示意图为___________ ,前四周期中未成对电子数最多的元素在周期表中位置为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/molI2=1451kJ/mol I3=7733kJ/molI4=10540kJ/mol |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)实验室制备E的单质的离子反应方程式为
(4)B和A中非金属性较强的是
(5)C与D的第一电离能大小为
(6)G价电子排布图为
(7)F元素的原子结构示意图为
您最近一年使用:0次
名校
解题方法
6 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)用“>”或“<”填空:
第一电离能:P___________ S,离子半径:O2___________ Na+, 酸性:H2SO4 ___________ HClO4,电负性:Si___________ O。
(6)天然碱的主要成分为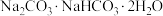 ,1mol
,1mol 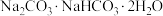 经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)用“>”或“<”填空:
第一电离能:P
(6)天然碱的主要成分为
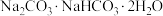 ,1mol
,1mol 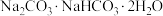 经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
7 . 我国正在建造第四艘航空母舰,镍铬钢抗腐蚀性能强,可用于建造航母。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态 原子的价电子排布式为
原子的价电子排布式为____________ ,基态 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为____________ 形,元素C、O、F的电负性由大到小的顺序为____________ 。
(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、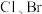 、I元素。
、I元素。
① 的空间构型为
的空间构型为____________ ,其中O原子杂化方式为____________ 杂化。
②海水综合利用中用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为____________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________ 。
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
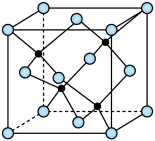
), 的配位数为
的配位数为____________ 。晶胞边长为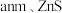 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________  。
。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态
 原子的价电子排布式为
原子的价电子排布式为 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、
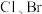 、I元素。
、I元素。①
 的空间构型为
的空间构型为②海水综合利用中用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。
 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
), 的配位数为
的配位数为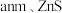 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 。
。
您最近一年使用:0次
名校
解题方法
8 . I.近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子简化的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的所在的原子轨道为_______ 形。与As位于同一周期,且未成对电子数也相同的元素有_______ (写元素符号)。
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为_______ ;BH 的空间构型为
的空间构型为_______ 。
(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为_______ 、_______ 。乙二胺能与Cu2+、Mg2+等金属离子形成稳定环状离子,其原因是_______ 。其中与乙二胺形成的化合物稳定性相对较高的是_______ (填Cu2+或Mg2+)。
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的_______ 区,Cu、Zn的第二电离能(I2):_______ >_______ 。
(5)下列状态的铜,电离最外层一个电子所需能量最大的是_______ 。
(6)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如图步骤完成实验:
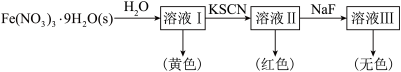
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有_______ molσ键;[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,其原因是_______ ,为了能观察到溶液I中[Fe(H2O)6]3+的浅紫色,可采取的方法是_______ 。
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,_______ 。
(1)基态砷原子简化的核外电子排布式为
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的
(5)下列状态的铜,电离最外层一个电子所需能量最大的是
| A.[Ar]3d104s1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104p1 |

已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,
您最近一年使用:0次
名校
解题方法
9 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(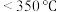 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(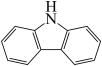 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(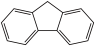 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
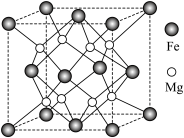
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(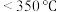 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
342次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
名校
解题方法
10 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原产物为_____ 。
(2)Ti-Fe合金室温下吸、放氢的速率快,Ti元素在周期表中的位置是____ 。
(3)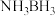 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
①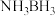 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是______ 。
②键角:
_____  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是_______ 。
(4)Fe-Mg合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
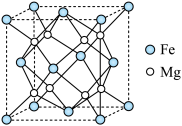
①距离Mg原子最近的Fe原子个数是___________ 。
②若该晶胞的棱长为anm,阿伏加德罗常数的值为 ,则该合金的密度为
,则该合金的密度为___________  。
。
③若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原产物为
(2)Ti-Fe合金室温下吸、放氢的速率快,Ti元素在周期表中的位置是
(3)
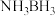 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①
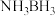 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是②键角:

 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(4)Fe-Mg合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是
②若该晶胞的棱长为anm,阿伏加德罗常数的值为
 ,则该合金的密度为
,则该合金的密度为 。
。③若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-03-30更新
|
830次组卷
|
2卷引用:天津市南开区2022-2023学年高三下学期质量检测(一)化学试题



