名校
解题方法
1 . 含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
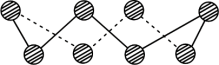
(3)Se的核外M层电子的排布式为_______ 。
(4)关于物质I~Ⅳ,下列说法正确的有_______ 。
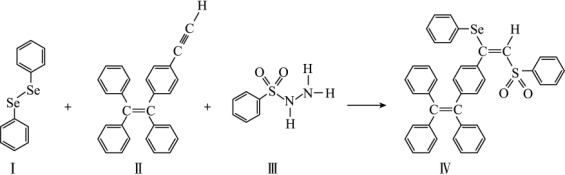
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是_______ 。
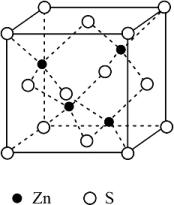
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为apm,密度为_______ gcm3(NA表示阿伏加德罗常数的值)。
(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)Se的核外M层电子的排布式为
(4)关于物质I~Ⅳ,下列说法正确的有

A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

您最近一年使用:0次
名校
2 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素G在周期表中的位置为_______ ,价电子排布式为_______ 。
(2)A、B、C三种元素的第一电离能由大到小为:_______ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为_______ 。
(4)D、E、F三种元素的电负性由大到小为:_______ 。
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为_______ 。阴极产物为_______
(6)工业上冶炼单质E的化学反应方程式_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)A、B、C三种元素的第一电离能由大到小为:
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,键角由大到小的顺序为
(4)D、E、F三种元素的电负性由大到小为:
(5)电解D与F形成的化合物的水溶液在工业上有着重要应用,其电解的总反应化学方程式为
(6)工业上冶炼单质E的化学反应方程式
您最近一年使用:0次
3 . 已知A、B、C、D、E为原子序数依次增大的前36号元素,A的2p轨道有3个电子;B是地壳中含量最多的元素;C元素的M层有一个电子;D元素形成的单质具有两性;E的基态原子的电子排布为[Ar]3d104S1。回答下列问题(用元素符号或化学式表示):
(1)A的最高能级电子云呈_______ 形,B的价层电子轨道表达式是_______ 。
(2)D的基态原子核外电子排布式为_______ 。
(3)A、B的第一电离能由小到大顺序是_______ (填元素符号)。
(4)B、C、D的电负性由小到大的顺序为_______ (填元素符号)。
(5)B、C、D的原子半径由小到大的顺序为_______ (填元素符号)。
(6)E在元素周期表中的位置_______ ,位于_______ 区。
(1)A的最高能级电子云呈
(2)D的基态原子核外电子排布式为
(3)A、B的第一电离能由小到大顺序是
(4)B、C、D的电负性由小到大的顺序为
(5)B、C、D的原子半径由小到大的顺序为
(6)E在元素周期表中的位置
您最近一年使用:0次
4 . 根据原子结构与性质的相关知识,请回答下列问题:
(1)基态S原子电子占据最高能层的符号是______ ,最高能级的电子云轮廓图为______ 形。
(2)电负性As______ Se(填“大于”或“小于”)。
(3) 基态核外电子排布式为
基态核外电子排布式为______ ,基态磷原子的核外价电子排布图为______ 。
(4)铜元素在元素周期表中的位置是______ ,位于元素周期表的______ 区。
(5)C、N、O的第一电离能由大到小的顺序为______ 。
(6)已知 和
和 反应放热,且断开1molH−H键、1molO=O键、1molO−H键吸收的能量分别为
反应放热,且断开1molH−H键、1molO=O键、1molO−H键吸收的能量分别为 kJ、
kJ、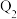 kJ、
kJ、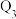 kJ,由此推知下列关系正确的是______(填选项字母)。
kJ,由此推知下列关系正确的是______(填选项字母)。
(1)基态S原子电子占据最高能层的符号是
(2)电负性As
(3)
 基态核外电子排布式为
基态核外电子排布式为(4)铜元素在元素周期表中的位置是
(5)C、N、O的第一电离能由大到小的顺序为
(6)已知
 和
和 反应放热,且断开1molH−H键、1molO=O键、1molO−H键吸收的能量分别为
反应放热,且断开1molH−H键、1molO=O键、1molO−H键吸收的能量分别为 kJ、
kJ、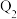 kJ、
kJ、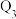 kJ,由此推知下列关系正确的是______(填选项字母)。
kJ,由此推知下列关系正确的是______(填选项字母)。A.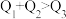 | B.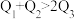 | C.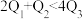 | D.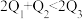 |
您最近一年使用:0次
名校
5 . 用元素周期表中的部分元素及其化合物回答下列问题。
(1)C的基态原子的电子排布式_______ ;Zn在周期表中的位置是_______ 。
(2)C、N、O原子电负性由小到大顺序为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
(3) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ ,C原子的杂化方式为_______ , 分子为
分子为_______ 。(填“极性分子”或“非极性分子”)
(4)Au与NaCN溶液在 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:_______ 。
(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与 等距且最近的
等距且最近的 有
有_______ 个。已知该晶胞参数为dnm,晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
_______  。
。
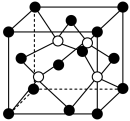
(1)C的基态原子的电子排布式
(2)C、N、O原子电负性由小到大顺序为
 的空间构型为
的空间构型为(3)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为 分子为
分子为(4)Au与NaCN溶液在
 气氛中生成配离子
气氛中生成配离子 ,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:
,将金从难溶矿石中溶解与其不溶物分离,再用还原剂Zn置换得到金(已知锌作为中心离子配位数为4)。写出上述有关反应的离子方程式:(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn,○=S)。与
 等距且最近的
等距且最近的 有
有 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
 。
。
您最近一年使用:0次
解题方法
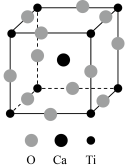
6 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。Ti在元素周期表中的位置____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是____ ;金属离子与氧离子间的作用力为____ ,Ca2+的配位数是____ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是

您最近一年使用:0次
7 . I.表中列出了第三周期的几种元素的部分性质:
请按要求回答下列问题:
(1)写出基态a原子的价层电子排布式:____ 。
(2)表中元素原子半径最大的是(写元素符号)_____ 。
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)_____ 。
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为_____ 。
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)____ 。
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为____ 。
(7)下列说法合理的是____ 。
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出基态a原子的价层电子排布式:
(2)表中元素原子半径最大的是(写元素符号)
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为
(7)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
名校
解题方法
8 . 过氧乙酸又名过醋酸(C2H4O3),是重要化工原料。也是一种绿色生态杀菌剂,其制法为CH3COOH+H2O2=CH3COOOH+H2O。
(1)某同学写出了碳原子的4种不同状态的电子排布图____ 。
A.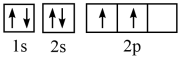 B.
B.
C.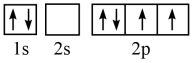 D.
D.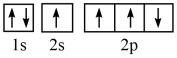
其中能量最低的是____ (填标号),电子由状态C到状态B所得到的光谱为____ 光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有____ 。
(3)乙酸比乙醇易电离出H+的原因____ 。
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是____ (用元素符号表示)。
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
解释表中两种物质熔点差异的原因____ 。
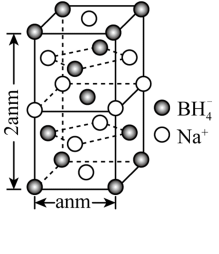
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为____ 。已知:硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=___ nm(用含ρ、NA的最简式子表示)
(1)某同学写出了碳原子的4种不同状态的电子排布图
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
(2)过氧乙酸分子中C原子的杂化方式有
(3)乙酸比乙醇易电离出H+的原因
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
| 硼氢化物 | NaBH4 | Al(BH4)3 |
| 熔点/℃ | 400 | -64.5 |
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为

您最近一年使用:0次
2022-06-29更新
|
608次组卷
|
4卷引用:天津市第四十五中学2023-2024学年高三12月月考化学试题
天津市第四十五中学2023-2024学年高三12月月考化学试题广西河池高级中学2022届高三下学期4月考试理科综合化学试题(已下线)2022年海南省高考真题变式题15-19宁夏六盘山高级中学2023-2024学年高三一模考试化学试题
解题方法
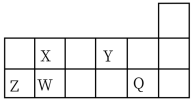
9 . 短周期元素 、
、 、
、 、
、 、
、 在元素周期表中相对位置如图所示。请用
在元素周期表中相对位置如图所示。请用化学用语 回答下列问题:
(1) 、
、 的离子半径由大到小的顺序为
的离子半径由大到小的顺序为_______ ; 、
、 、
、 元素的电负性最大的是
元素的电负性最大的是_______ 。
(2)下列说法正确的是_______
a. 和
和 都能溶于水生成对应的酸
都能溶于水生成对应的酸
b. 的含氧酸的酸性比
的含氧酸的酸性比 的含氧酸的酸性强
的含氧酸的酸性强
c. 的最简单气态氢化物的稳定性大于
的最简单气态氢化物的稳定性大于 的最简单气态氢化物的稳定性
的最简单气态氢化物的稳定性
d. 由 溶液分别滴入
溶液分别滴入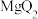 、
、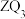 溶液中的反应现象可比较
溶液中的反应现象可比较 和
和 金属性的强弱
金属性的强弱
(3) 与
与 两元素的单质反应生成
两元素的单质反应生成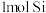 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热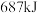 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为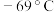 和
和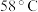 。写出该反应的热化学方程式
。写出该反应的热化学方程式_______ 。
(4)自来水厂用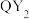 对饮用水进行消毒,处理后的水中要求
对饮用水进行消毒,处理后的水中要求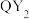 浓度在
浓度在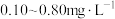 之间。碘量法可以检测水
之间。碘量法可以检测水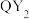 的浓度,步骤如下:
的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用 溶液调至中性,并加入淀粉溶液,溶液变蓝。
溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的 溶液。(已知:
溶液。(已知: )
)
操作Ⅲ:然后再加硫酸调节水样 至1~3。
至1~3。
操作时,不同 环境中
环境中 元素粒子种类及化合价如图所示:
元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是_______ 。
②确定操作II完全反应的现象是_______ 。
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是_______ 。
 、
、 、
、 、
、 、
、 在元素周期表中相对位置如图所示。请用
在元素周期表中相对位置如图所示。请用
(1)
 、
、 的离子半径由大到小的顺序为
的离子半径由大到小的顺序为 、
、 、
、 元素的电负性最大的是
元素的电负性最大的是(2)下列说法正确的是
a.
 和
和 都能溶于水生成对应的酸
都能溶于水生成对应的酸b.
 的含氧酸的酸性比
的含氧酸的酸性比 的含氧酸的酸性强
的含氧酸的酸性强c.
 的最简单气态氢化物的稳定性大于
的最简单气态氢化物的稳定性大于 的最简单气态氢化物的稳定性
的最简单气态氢化物的稳定性d. 由
 溶液分别滴入
溶液分别滴入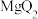 、
、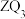 溶液中的反应现象可比较
溶液中的反应现象可比较 和
和 金属性的强弱
金属性的强弱(3)
 与
与 两元素的单质反应生成
两元素的单质反应生成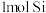 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热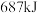 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为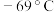 和
和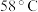 。写出该反应的热化学方程式
。写出该反应的热化学方程式(4)自来水厂用
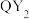 对饮用水进行消毒,处理后的水中要求
对饮用水进行消毒,处理后的水中要求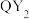 浓度在
浓度在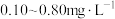 之间。碘量法可以检测水
之间。碘量法可以检测水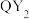 的浓度,步骤如下:
的浓度,步骤如下:操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用
 溶液调至中性,并加入淀粉溶液,溶液变蓝。
溶液调至中性,并加入淀粉溶液,溶液变蓝。操作Ⅱ:再加入一定量的
 溶液。(已知:
溶液。(已知: )
)操作Ⅲ:然后再加硫酸调节水样
 至1~3。
至1~3。操作时,不同
 环境中
环境中 元素粒子种类及化合价如图所示:
元素粒子种类及化合价如图所示:
①操作I中反应的离子方程式是
②确定操作II完全反应的现象是
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是
您最近一年使用:0次
名校
10 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的电子排布式为[Ar]___________ ,Ti原子核外有___________ 种空间运动状态不同的电子。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由大到小的顺序为___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为___________ 。
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③乙二胺形成配合物后,H-N-H键角将变大,原因是___________ 。
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为___________ pm(列出计算式)。

(1)基态Ti原子的电子排布式为[Ar]
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
①乙二胺中,N原子的杂化方式为
②1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③乙二胺形成配合物后,H-N-H键角将变大,原因是
(4)钙钛矿(主要成分CaTiO3),晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则相距最近的Ca和O之间的距离为

您最近一年使用:0次
2022-03-10更新
|
231次组卷
|
2卷引用:天津市滨海新区七所重点学校2021-2022学年高三下学期联考化学试题



