钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。Ti在元素周期表中的位置____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
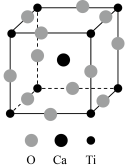
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是____ ;金属离子与氧离子间的作用力为____ ,Ca2+的配位数是____ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是

更新时间:2022-12-02 16:37:57
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:
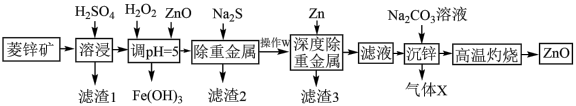
(1)写出Ni、Fe元素在周期表中的位置_______ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释_______ 。
(2)加入H2O2的目的是_______ ;“调pH”时除ZnO外还可以选用的物质是_______ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了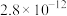 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为_______ 。证明Fe3+已除尽的化学方法是_______ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:_______ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为_______ 。
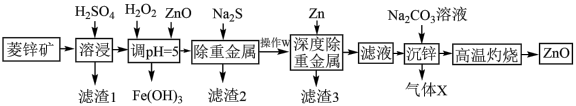
(1)写出Ni、Fe元素在周期表中的位置
(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
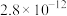 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】有A、B、C、D、E五种元素。其中A为第三周期主族元素,与D可形成原子个数比为1∶1和2∶1的化合物;B为第4周期过渡金属元素,且未成对电子数最多,最高化合价为+6价;C和A是同周期的元素,最高化合价为+7;D原子的价电子排布为nsnnpn+2,E元素的基态原子核外有7个原子轨道填充了电子。
(1)写出下面三种元素的元素符号:A___________ 、B___________ 、C___________ 。
(2)写出D2-的电子排布式:___________ 。基态E原子的外围电子排布图___________ 。
(3)C位于___________ 族,B位于___________ 区。
(1)写出下面三种元素的元素符号:A
(2)写出D2-的电子排布式:
(3)C位于
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】完成下列问题
(1)基态铬原子的核外电子排布式为_______ ,有_______ 个未成对电子。
(2) 能形成配合物
能形成配合物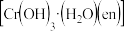 ,其中“en”代表
,其中“en”代表 。
。
①在该配合物中,提供孤电子对的原子是_______ (填元素符号)。
② “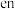 ”中采用
”中采用 杂化的原子是
杂化的原子是_______ (填元素符号)。
③在该配合物中,短周期元素按电负性由大到小的排列顺序为_______ (填元素符号)。
(3) 晶体的熔点为
晶体的熔点为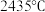 ,而
,而 晶体易升华,其主要原因是
晶体易升华,其主要原因是_______ 。
(4) 晶胞结构示意图。已知
晶胞结构示意图。已知 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为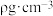 ,晶胞体积为
,晶胞体积为 。则:
。则:
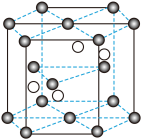
①晶胞结构示意图中的“小黑球”代表_______ (填“铬离子”或“氧离子”),1个晶胞中平均含有小黑球的个数是_______ 个。
②阿伏加德罗常数NA=_____ mol-1(用含 、
、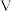 、
、 的代数式表示)。
的代数式表示)。
(1)基态铬原子的核外电子排布式为
(2)
 能形成配合物
能形成配合物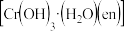 ,其中“en”代表
,其中“en”代表 。
。①在该配合物中,提供孤电子对的原子是
② “
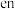 ”中采用
”中采用 杂化的原子是
杂化的原子是③在该配合物中,短周期元素按电负性由大到小的排列顺序为
(3)
 晶体的熔点为
晶体的熔点为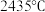 ,而
,而 晶体易升华,其主要原因是
晶体易升华,其主要原因是(4)
 晶胞结构示意图。已知
晶胞结构示意图。已知 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为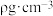 ,晶胞体积为
,晶胞体积为 。则:
。则:
①晶胞结构示意图中的“小黑球”代表
②阿伏加德罗常数NA=
 、
、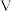 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐1】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
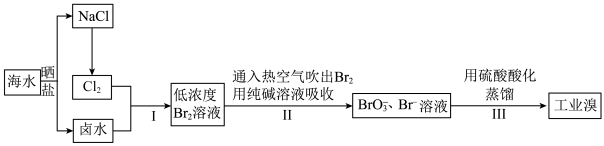
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: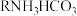 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
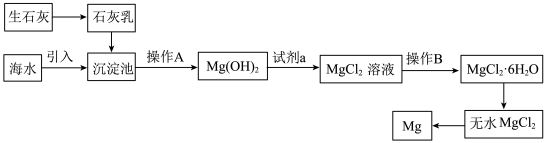
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

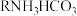 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】氢能是一种极具发展潜力的清洁能源,下列物质是具有广阔应用前景的储氢材料。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的化学方程式为___________ 。
(2) (氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
① 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是___________ (填元素符号,下同);根据对角线规则,B的一些化学性质与元素___________ 相似。
② 分子中存在配位键,
分子中存在配位键,___________ 原子提供空轨道,___________ 原子提供孤对电子。
③键角:
___________  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是___________ 。
(3)某种新型储氢材料的晶胞如图。

①该物质摩尔质量为188g/mol,其化学式为___________ 。
②该化合物中M离子的价电子排布图为___________ 。
③该晶体密度为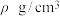 ,晶胞的边长为
,晶胞的边长为___________ nm。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的化学方程式为
(2)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度,是颇具潜力的储氢材料,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①
 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是②
 分子中存在配位键,
分子中存在配位键,③键角:

 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(3)某种新型储氢材料的晶胞如图。

①该物质摩尔质量为188g/mol,其化学式为
②该化合物中M离子的价电子排布图为
③该晶体密度为
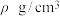 ,晶胞的边长为
,晶胞的边长为
您最近一年使用:0次
【推荐3】①~⑥六种元素在元素周期表中的位置如下表。
回答下列问题:
(1)①的元素名称是_______ 。
(2)①、②的简单氢化物中,熔沸点较高的是_______ (填化学式)。
(3)③、④、⑤三种元素中,电负性最大的是_______ (填元素符号)。
(4)③、④两种元素的原子中,第一电离能较大的是_______ (填元素符号)。
(5)⑥的基态原子的核外电子排布式是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ||||
| 4 | ⑥ |
(1)①的元素名称是
(2)①、②的简单氢化物中,熔沸点较高的是
(3)③、④、⑤三种元素中,电负性最大的是
(4)③、④两种元素的原子中,第一电离能较大的是
(5)⑥的基态原子的核外电子排布式是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】天门冬氨酸锌是一种补锌剂,可以用天门冬氨酸(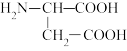 )和锌的化合物为原料制备。
)和锌的化合物为原料制备。
(1)天门冬氨酸分子中氮原子的轨道杂化类型为___ ;天门冬氨酸所含σ键和π键的数目之比为___ ;其所含四种元素电负性由大到小的顺序为___ 。
(2)Zn(NO3)2中所含NO 的空间构型为
的空间构型为___ (用文字描述)。
(3)工业ZnCl2中常混有杂质TiCl4,TiCl4室温下为无色液体,熔沸点低,易升华,可溶于甲苯和氯代烃等非极性溶剂中,它的晶体类型是___ 。Ti的核外电子排布式为___ 。
(4)ZnO的晶胞结构如图所示,Zn2+的配位数为___ 。

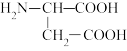 )和锌的化合物为原料制备。
)和锌的化合物为原料制备。(1)天门冬氨酸分子中氮原子的轨道杂化类型为
(2)Zn(NO3)2中所含NO
 的空间构型为
的空间构型为(3)工业ZnCl2中常混有杂质TiCl4,TiCl4室温下为无色液体,熔沸点低,易升华,可溶于甲苯和氯代烃等非极性溶剂中,它的晶体类型是
(4)ZnO的晶胞结构如图所示,Zn2+的配位数为

您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】实验室用氨法浸出氧化锌烟尘制备活性ZnO,其主要实验流程如下:
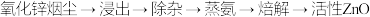
(1)浸出。用一定浓度的氨水和 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。
①烟尘中的主要成分ZnO发生反应的化学方程式为___________ 。
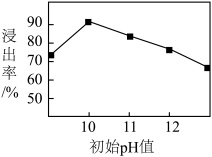
②锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。
(2)除杂。 、
、 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以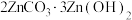 沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为
沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为___________ 。
(4)焙解。已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌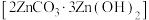 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
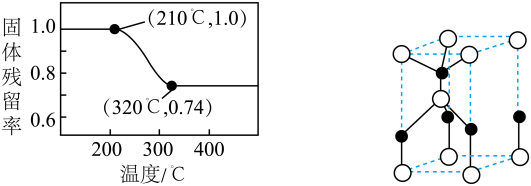
①275℃时,碱式碳酸锌分解产生的气态物质为___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)浸出。用一定浓度的氨水和
 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。①烟尘中的主要成分ZnO发生反应的化学方程式为
②锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是

(2)除杂。
 、
、 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它们置换除去。写出Zn粉和铜氨配合物反应的离子方程式(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以
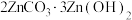 沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为
沉淀形式从溶液中析出。该过程需保持恒温80℃,可采取的加热方式为(4)焙解。已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌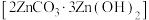 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
①275℃时,碱式碳酸锌分解产生的气态物质为
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近一年使用:0次
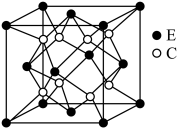
【推荐3】已知A、B、C、D、E和F都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子价电子排布式为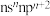 ,C和D属同一主族,E和F属同一周期,又知F是周期表中1~18列中的第13列元素。C是周期表中电负性最大的元素,C跟E可形成离子化合物其晶胞结构如图。
,C和D属同一主族,E和F属同一周期,又知F是周期表中1~18列中的第13列元素。C是周期表中电负性最大的元素,C跟E可形成离子化合物其晶胞结构如图。
(1)元素F的符号是_____ ,基态F原子中有_____ 种能量不同的电子,其价电子轨道表示式为_____ 。
(2)C与A形成的化合物比D与A形成的化合物沸点高,其原因是_____ 。
(3)从图中可以看出,C跟E形成的离子化合物的化学式为_____ ;E离子配位数为_____ 。
(4)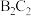 是一种强氧化剂,由
是一种强氧化剂,由 和
和 在低温下合成,
在低温下合成,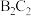 分子的电子式为
分子的电子式为_____ ,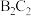 是
是_____ (填“极性”或“非极性”)分子。
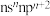 ,C和D属同一主族,E和F属同一周期,又知F是周期表中1~18列中的第13列元素。C是周期表中电负性最大的元素,C跟E可形成离子化合物其晶胞结构如图。
,C和D属同一主族,E和F属同一周期,又知F是周期表中1~18列中的第13列元素。C是周期表中电负性最大的元素,C跟E可形成离子化合物其晶胞结构如图。
(1)元素F的符号是
(2)C与A形成的化合物比D与A形成的化合物沸点高,其原因是
(3)从图中可以看出,C跟E形成的离子化合物的化学式为
(4)
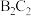 是一种强氧化剂,由
是一种强氧化剂,由 和
和 在低温下合成,
在低温下合成,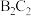 分子的电子式为
分子的电子式为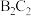 是
是
您最近一年使用:0次



