1 . 完成下列问题。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:___________<x(Mg)<___________。___________
(2)指出下列两种化合物中氧元素的化合价:HClO___________ ,HFO___________ 。有机物结构式为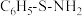 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向___________ 。
(3)成键的两原子相应元素x数值的差值为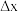 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是___________ 。
(4)预测元素周期表中,x值最小的元素位于___________ 周期___________ 族(放射性元素除外)。
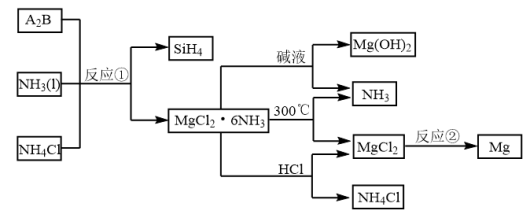
Ⅱ.下图中反应①是制备 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
(5)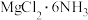 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):___________ 。
(6)A2B的化学式为___________ 。上图中可以循环使用的物质有___________ (化学式)。
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料___________ 。
(8)为实现燃煤脱硫,煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:___________ 。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | N | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.0 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)指出下列两种化合物中氧元素的化合价:HClO
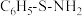 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向(3)成键的两原子相应元素x数值的差值为
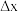 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是(4)预测元素周期表中,x值最小的元素位于
Ⅱ.下图中反应①是制备
 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
(5)
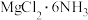 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):(6)A2B的化学式为
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(8)为实现燃煤脱硫,煤中加入浆状
 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 元素X、Y、Z、T、R的原子序数依次增大且小于20,其最外层电子数与原子半径间大大小关系如图所示。
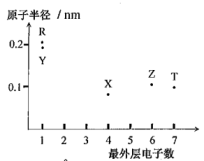
请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:_______ 。
(2)上述五种元素中,电负性最大的是(写元素符号,下同)_______ ,第一电离能最小的是_______ 。
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)_______ 。
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为_______ 。
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:_______ 。通过观察现象得出的结论:相同条件下,同主族元素R的金属性比Y的强。
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:_______ 。欲观察到现象为:_______ ;结论:_______ 。

请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:
(2)上述五种元素中,电负性最大的是(写元素符号,下同)
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:
您最近一年使用:0次
名校
3 . 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为___________ 。
(2)甲脒(FA)的结构简式为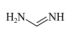
①其组成元素的电负性由小到大的排序为___________ ,其中碳原子的杂化方式为___________ 。
②甲脒比丙烷的熔点更高的原因是___________ 。
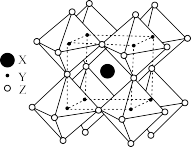
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___________ 。
(1)基态S原子的价电子排布图为
(2)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为

您最近一年使用:0次
2021-10-13更新
|
584次组卷
|
5卷引用:天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题
天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题天津市五校2023届高三一模联考化学试题福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题(已下线)第19讲元素周期律与元素周期表(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
4 . 下列有关N、P及其化合物的说法错误的是
| A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 |
| B.N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 |
| C.NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 |
| D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低 |
您最近一年使用:0次
2021-10-09更新
|
8287次组卷
|
21卷引用:天津市和平区2021-2022学年高二下学期期末考试化学试题
天津市和平区2021-2022学年高二下学期期末考试化学试题天津市和平区2021-2022学年高二下学期期末样卷化学试题2021年新高考湖北化学高考真题2021年湖北高考化学试题变式题1-10(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题(已下线)专题八 物质结构与元素周期律-实战高考·二轮复习核心突破湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题(已下线)第3讲 化学键 共价键的类型及键参数(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 分子结构与性质广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
真题
名校
5 . 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
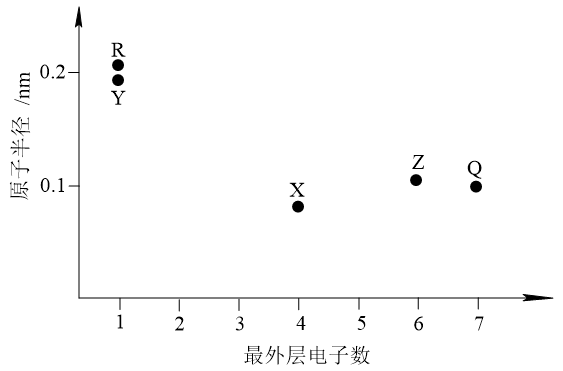

| A.X的电负性比Q的大 |
| B.Q的简单离子半径比R的大 |
| C.Z的简单气态氢化物的热稳定性比Q的强 |
| D.Y的最高价氧化物对应的水化物的碱性比R的强 |
您最近一年使用:0次
2021-09-07更新
|
6144次组卷
|
16卷引用:2021年新高考天津化学高考真题
2021年新高考天津化学高考真题2021年天津高考化学试题变式题1-12天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题天津市南仓中学2023-2024学年高三上学期教学质量过程性检测与诊断化学试卷湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)易错点14 元素周期表和元素周期律-备战2023年高考化学考试易错题福建省福州第十五中学2022-2023学年高三上学期11月线上限时训练化学试题(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律(已下线)题型10 元素“位—构—性”关系的综合应用广东番禺中学2022-2023学年高二下学期4月期中考试化学试题(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)广东省普宁市勤建学校2023-2024学年高三上学期第三次月考化学试题
解题方法
6 . 过渡元素镍(Ni)、钒(V)、钛(Ti)等在工业上具有广泛的用途,根据原子结构与周期表及元素的性质,向答下列问题:
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为___ (填元素符号),配位体的电子式为___ ,阴离子的立体构型是___ 。
(2)基态23V原子的电子排布式为___ ,其氧化物V2O5难溶于水,可以由VOCl3(易溶于水)水解来制备,反应的化学方程式为___ 。
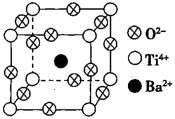
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=___ cm(列出计算式,用ρ表示)。
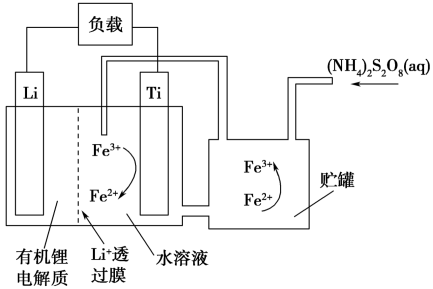
(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式___ ,充电时,钛电极与电源___ 极相连。
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为
(2)基态23V原子的电子排布式为
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=

(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式

您最近一年使用:0次
2021-05-14更新
|
234次组卷
|
2卷引用:天津市河北区2021届高三年级总复习质量检测(二)化学试题
名校
解题方法
7 . 如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
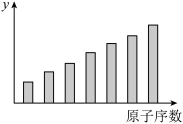
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
您最近一年使用:0次
2021-04-24更新
|
964次组卷
|
50卷引用:天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题
天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题天津市九十六中学2023-2024学年高三上学期12月月考化学试题(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷湖北省蕲春县2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题山东省师范大学附属中学2017-2018学年高二下学期第七次学分认定考试(期中)(理)化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题山东省济宁市2018-2019学年高二期末模块检测化学试题宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题四川省南充市白塔中学2019-2020学年高二上学期期中考试化学试题人教化学选修3第一章第二节课时5福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题安徽省定远县育才学校2019-2020学年高一6月月考化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省建瓯市芝华中学2019-2020学年高二下学期第一次阶段考试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题福建省漳州市正兴学校等三校2021-2022学年高二下学期期中联考化学试题甘肃省兰州第一中学2021-2022学年高二下学期期中考试化学试题福建省宁德市柘荣县第一中学2021-2022学年高二下学期月考八化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题河北省石家庄市第二十七中学2022-2023学年高三上学期九月月考化学试题新疆疏勒县实验学校2021-2022学年高二下学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题重庆市缙云教育联盟2022-2023学年高二上学期期末联考化学试题黑龙江省大庆市大庆中学2022-2023学年高二下学期4月月考化学试题新疆维吾尔自治区皮山县高级中学2022-2023学年高二下学期4月期中化学试题福建省南平市浦城县2022-2023学年高二下学期期中考试化学试题重庆市2022-2023学年高二上学期期末考试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省阆中中学校2023-2024学年高二下学期4月期中化学试题
名校
8 . 我国科学家在材料研发中取得了较大的进展,例如嫦娥四号探测器所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。再例如我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。请回答下列问题
(1)基态As原子的核外价电子排布图为_______ 。
(2)砷的电负性比镓_______ (填“大”或“小”)。
(3)硒所在的主族中,简单的气态氢化物沸点最低的是_______ (填化学式)。
(4)电还原制备 的原理:
的原理: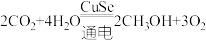 ,在该反应中,含极性键的非极性分子是
,在该反应中,含极性键的非极性分子是_______ (填化学式)。
(5)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键。6个2p轨道垂直平面形成稳定的大π键,符号为 (右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为
(右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为 ,不能与溴水发生反应,由此推知,该分子中大π键表示为
,不能与溴水发生反应,由此推知,该分子中大π键表示为_______ 。
(6)废旧印刷电路板中含有铜,为了保护环境和节约资源,通常先用 和稀硫酸的混合溶液溶解铜,写出其离子方程式
和稀硫酸的混合溶液溶解铜,写出其离子方程式_______ 。
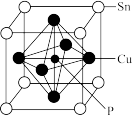
(7)磷青铜晶胞结构如图所示,它由Cu、Sn和P构成,锡原子位于立方体顶点,铜原子位于面心,P原子位于铜原子构成的正八面体的体心。则磷青铜的化学式为_______ 。
(1)基态As原子的核外价电子排布图为
(2)砷的电负性比镓
(3)硒所在的主族中,简单的气态氢化物沸点最低的是
(4)电还原制备
 的原理:
的原理: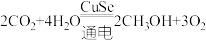 ,在该反应中,含极性键的非极性分子是
,在该反应中,含极性键的非极性分子是(5)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键。6个2p轨道垂直平面形成稳定的大π键,符号为
 (右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为
(右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为 ,不能与溴水发生反应,由此推知,该分子中大π键表示为
,不能与溴水发生反应,由此推知,该分子中大π键表示为(6)废旧印刷电路板中含有铜,为了保护环境和节约资源,通常先用
 和稀硫酸的混合溶液溶解铜,写出其离子方程式
和稀硫酸的混合溶液溶解铜,写出其离子方程式(7)磷青铜晶胞结构如图所示,它由Cu、Sn和P构成,锡原子位于立方体顶点,铜原子位于面心,P原子位于铜原子构成的正八面体的体心。则磷青铜的化学式为

您最近一年使用:0次
21-22高三上·天津·期末
名校
解题方法
9 . 现有四种元素的基态原子的电子排布式如下,则下列判断正确的是
① ②
② ③
③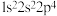 ④
④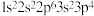
①
 ②
② ③
③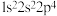 ④
④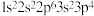
| A.第一电离能:④>③ | B.电负性:③>② |
| C.离子半径:②>④ | D.氢化物的沸点:③>① |
您最近一年使用:0次
10 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A元素原子1s轨道只有1个电子;B元素原子第二能层的最高能级不同轨道上都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
(1)A原子的电子式:___________ 。
(2)B原子的轨道表示式:___________ 。
(3)A、B、C三种元素的电负性:___________ >___________ >___________
(4)B、C、D元素的第一电离能:___________ >___________ >___________
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、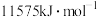 。
。
①E元素原子逐级电离能越来越大的原因:___________ 。
②这些数据说明E的最高正化合价为___________ 。
(6)关于F元素:
①位于周期表的___________ 区;
②它的价电子排布式为___________ ;
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:___________ 。
 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。(1)A原子的电子式:
(2)B原子的轨道表示式:
(3)A、B、C三种元素的电负性:
(4)B、C、D元素的第一电离能:
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、
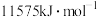 。
。①E元素原子逐级电离能越来越大的原因:
②这些数据说明E的最高正化合价为
(6)关于F元素:
①位于周期表的
②它的价电子排布式为
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:
您最近一年使用:0次



