已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A元素原子1s轨道只有1个电子;B元素原子第二能层的最高能级不同轨道上都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
(1)A原子的电子式:___________ 。
(2)B原子的轨道表示式:___________ 。
(3)A、B、C三种元素的电负性:___________ >___________ >___________
(4)B、C、D元素的第一电离能:___________ >___________ >___________
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、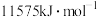 。
。
①E元素原子逐级电离能越来越大的原因:___________ 。
②这些数据说明E的最高正化合价为___________ 。
(6)关于F元素:
①位于周期表的___________ 区;
②它的价电子排布式为___________ ;
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:___________ 。
 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。(1)A原子的电子式:
(2)B原子的轨道表示式:
(3)A、B、C三种元素的电负性:
(4)B、C、D元素的第一电离能:
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、
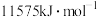 。
。①E元素原子逐级电离能越来越大的原因:
②这些数据说明E的最高正化合价为
(6)关于F元素:
①位于周期表的
②它的价电子排布式为
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:
更新时间:2021/01/26 09:55:46
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】锌是一种重要金属,原子序数为30.回答下列问题:
(1)锌元素位于元素周期表_______ 区,Zn的价层电子排布式为_______ 。
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3)一种锌的配合物结构简式如图所示,结构中的C原子有_______ 种杂化方式,其中标注“★”的C原子为_______ 杂化。

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:_______ 。

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为_______ cm(用含d和NA的代数式表示)。

(1)锌元素位于元素周期表
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是
(3)一种锌的配合物结构简式如图所示,结构中的C原子有

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)等物质的量的CH3CN和CO中,π键数目之比___________ 。
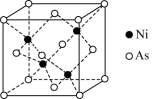
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。
(1)Li、P、S三种元素中,电负性最小的是
(2)基态As原子的电子排布式为
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)等物质的量的CH3CN和CO中,π键数目之比
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】X、Y、Z、M、R、W均为周期表中前四周期的元素。X的基态原子价电子排布式为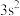 ;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是第三周期原子半径最小的元素;W为过渡元素,它的基态原子价电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是第三周期原子半径最小的元素;W为过渡元素,它的基态原子价电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的价电子排布的轨道表示式为_______ 。其基态原子有_______ 种能量不同的电子;
(2)X位于周期表中_______ 区;R的氢化物的稳定性比其上一周期同族元素氢化物的稳定性_______ 。(填“强”或“弱”)
(3)Y、Z、M、R的最高价氧化物对应的水化物中酸性最强的是_______ (填化学式)
(4)元素Z的氢化物的电子式为_______ ,该氢化物的分子空间结构为_______ ,该氢化物与元素Z的最高价氧化物对应的水化物反应的化学方程式为_______ 。
(5)M元素基态原子中能量最高的电子,其电子云在空间有_______ 个取向,原子轨道呈_______ 形。
(6)Y、Z、M三种元素的第一电离能由大到小的排列顺序为_______ 。
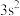 ;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是第三周期原子半径最小的元素;W为过渡元素,它的基态原子价电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是第三周期原子半径最小的元素;W为过渡元素,它的基态原子价电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):(1)W的基态原子的价电子排布的轨道表示式为
(2)X位于周期表中
(3)Y、Z、M、R的最高价氧化物对应的水化物中酸性最强的是
(4)元素Z的氢化物的电子式为
(5)M元素基态原子中能量最高的电子,其电子云在空间有
(6)Y、Z、M三种元素的第一电离能由大到小的排列顺序为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
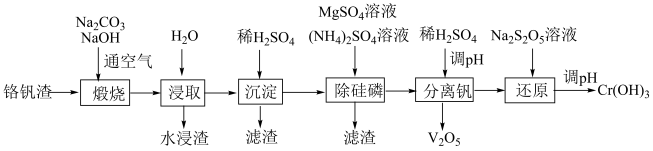
【推荐1】铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;
ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式_________ 。
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______ (填化学式)。
(3)水浸渣中主要物质为______ (填化学式)。
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是______ 。
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为________ 。
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮、磷、硫及其化合物的用途广泛。回答下列问题:
(1)下列四种N原子的电子排布图表示的状态中,能量由低到高的顺序是________
(用标号表示)。
A.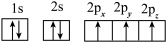 B.
B.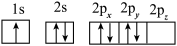
C.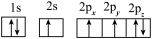 D.
D.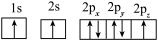
(2)羟氨(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N原子的杂化形式为____ 。羟氨易溶于水,其主要原因是____________ 。
(3)氮、磷、硫三种元素的第一电离能由大到小的顺序为________ (用元素符号表示),氮气分子中σ键与π键的数目之比为____ 氮、磷、砷三种元素的简单氢化物的沸点由高到低的顺序为____ (用化学式表示)。
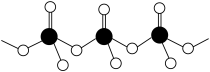
(4)直链多磷酸根阴离子(如图所示)是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,则由n个磷氧四面体形成的这类磷酸根离子的通式为______ 。
(5)ZnS晶体的晶胞如图所示(黑球代表Zn2+,白球代表S2-)。
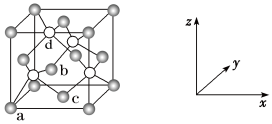
①在该晶胞中,Zn2+的配位数为________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置.。如图晶胞中,原子坐标参数a为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0)。则d的坐标参数为
,0)。则d的坐标参数为____ 。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则其中两个S2-之间的距离为____ pm(列出计算表达式)。
(1)下列四种N原子的电子排布图表示的状态中,能量由低到高的顺序是
(用标号表示)。
A.
 B.
B.
C.
 D.
D.
(2)羟氨(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N原子的杂化形式为
(3)氮、磷、硫三种元素的第一电离能由大到小的顺序为
(4)直链多磷酸根阴离子(如图所示)是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)ZnS晶体的晶胞如图所示(黑球代表Zn2+,白球代表S2-)。

①在该晶胞中,Zn2+的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置.。如图晶胞中,原子坐标参数a为(0,0,0);b为(
 ,0,
,0, );c为(
);c为( ,
, ,0)。则d的坐标参数为
,0)。则d的坐标参数为③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则其中两个S2-之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】有机阳离子是一类带正电荷的粒子,如 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。
(1)C原子价电子的轨道表示式为________ 。第一电离能N____ O(填“>”或“<”),原因是__________ 。
(2) 中N的杂化方式为
中N的杂化方式为____________________ 。从化学键的角度描述由 (甲胺)形成
(甲胺)形成 的过程
的过程____________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为__________ 。
(4)某材料中含有机阳离子,其晶胞结构如图所示。
①化学式为____________________ ;其中 周围最临近的
周围最临近的 个数为
个数为__________ 。
②已知晶体密度为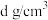 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为______  。
。
 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。(1)C原子价电子的轨道表示式为
(2)
 中N的杂化方式为
中N的杂化方式为 (甲胺)形成
(甲胺)形成 的过程
的过程(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为(4)某材料中含有机阳离子,其晶胞结构如图所示。

①化学式为
 周围最临近的
周围最临近的 个数为
个数为②已知晶体密度为
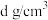 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】碱金属单质及其化合物在生产生活中有着重要价值。按要求回答下列问题。
(1)已知:原子序数小于铷(Rb)的碱金属元素X、Y、Z的第一电离能依次为520、496、419(单位: )。
)。
①基态X原子的核外电子排布式为_____ 。
②写出一项比较Rb与Z的金属性强弱的方法:_____ 。
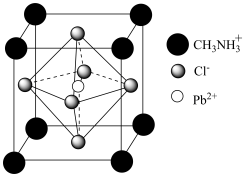
(2)钴酸锂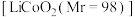 常用作锂离子电池的电极材料,它是一种立方晶胞如下图所示(仅表示出Li,未表示出Co和O):
常用作锂离子电池的电极材料,它是一种立方晶胞如下图所示(仅表示出Li,未表示出Co和O):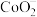 的个数为
的个数为_____ 。
②该晶胞密度为_____  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a的代数式表示)。
,用含a的代数式表示)。
(3)回收废旧电池得到粗品 ,再经如下两步制备成纯晶
,再经如下两步制备成纯晶 :
:
ⅰ.将粗品 溶于盐酸,作电解槽的阳极液;
溶于盐酸,作电解槽的阳极液; 溶液做阴极液,两者用离子交换膜隔开,用惰性电极电解:
溶液做阴极液,两者用离子交换膜隔开,用惰性电极电解:
ⅱ.向 溶液中加入少量
溶液中加入少量 溶液并共热,过滤、洗涤、干燥得纯品
溶液并共热,过滤、洗涤、干燥得纯品 。
。
①写出步骤ⅰ阳极的电极反应式:_____ ;离子交换膜宜选用_____ (填“阳离子交换膜”或“阴离子交换膜”)。
②步骤ⅱ加热条件下生成沉淀 的离子方程式是
的离子方程式是_____ 。
(1)已知:原子序数小于铷(Rb)的碱金属元素X、Y、Z的第一电离能依次为520、496、419(单位:
 )。
)。①基态X原子的核外电子排布式为
②写出一项比较Rb与Z的金属性强弱的方法:
(2)钴酸锂
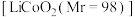 常用作锂离子电池的电极材料,它是一种立方晶胞如下图所示(仅表示出Li,未表示出Co和O):
常用作锂离子电池的电极材料,它是一种立方晶胞如下图所示(仅表示出Li,未表示出Co和O):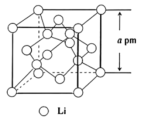
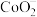 的个数为
的个数为②该晶胞密度为
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a的代数式表示)。
,用含a的代数式表示)。(3)回收废旧电池得到粗品
 ,再经如下两步制备成纯晶
,再经如下两步制备成纯晶 :
:ⅰ.将粗品
 溶于盐酸,作电解槽的阳极液;
溶于盐酸,作电解槽的阳极液; 溶液做阴极液,两者用离子交换膜隔开,用惰性电极电解:
溶液做阴极液,两者用离子交换膜隔开,用惰性电极电解:ⅱ.向
 溶液中加入少量
溶液中加入少量 溶液并共热,过滤、洗涤、干燥得纯品
溶液并共热,过滤、洗涤、干燥得纯品 。
。①写出步骤ⅰ阳极的电极反应式:
②步骤ⅱ加热条件下生成沉淀
 的离子方程式是
的离子方程式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铬铁合金常作为钢的添加料,用于生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢。
(1)画出基态铬原子的价电子排布图__________________________ 。
(2)K2Cr2O7是酒驾检测仪中的一种试剂,它与酒精反应可表示为K2Cr2O7+H2SO4+CH3CH2OH→Cr2(SO4)3+K2SO4+CH3COOH+H2O。
①CH3COOH分子中碳原子的杂化类型为________________ 。
②SO42–与H2O中键角较大的是_______ (填化学式),用价层电子对互斥理论解释______________________________________________________________________ 。
③写出一个SO42–的等电子体分子__________ 。
(3)铬离子(Cr3+)能形成多种配合物,例如[Cr(OH)3(H2O)(H2NCH2CH2NH2)]。
①上述配合物中的非金属元素按第一电离能由小到大的顺序排列为_______________ 。
②已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,Cr3+的配位数为________ 。
(4)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。

①该晶体的化学式为________ 。
②已知晶体中Ca2+与Cr4+的最短距离为a nm。则该晶胞密度为________ g/cm3。(列出计算表达式,NA表示阿伏加 德罗常数的值)
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为(1−x):x(x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为________ 。
(1)画出基态铬原子的价电子排布图
(2)K2Cr2O7是酒驾检测仪中的一种试剂,它与酒精反应可表示为K2Cr2O7+H2SO4+CH3CH2OH→Cr2(SO4)3+K2SO4+CH3COOH+H2O。
①CH3COOH分子中碳原子的杂化类型为
②SO42–与H2O中键角较大的是
③写出一个SO42–的等电子体分子
(3)铬离子(Cr3+)能形成多种配合物,例如[Cr(OH)3(H2O)(H2NCH2CH2NH2)]。
①上述配合物中的非金属元素按第一电离能由小到大的顺序排列为
②已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,Cr3+的配位数为
(4)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。

①该晶体的化学式为
②已知晶体中Ca2+与Cr4+的最短距离为a nm。则该晶胞密度为
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为(1−x):x(x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】元素周期表前四周期的元素A、B、C、D、E,原子序数依次增大。对于它们的基态原子而言,A的核外电子总数与其电子层数相同;B的价电子层中有3个未成对电子;C的最外层电子数为其内层电子数的3倍;D与C同主族;E的最外层只有1个电子,但次外层有18个电子。回答下列问题。
(1)B、C、D中第一电离能从大到小的顺序是___________ (用元素符号表示)。
(2)E的价层电子轨道表示式为___________ ,该原子核外电子有___________ 种空间运动状态。
(3)这些元素形成的含氧酸中,酸根离子呈三角锥形结构的酸是___________ (填化学式)。
(4)这五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构如图1所示。该化合物中阴离子为___________ (填化学式),该化合物加热时首先失去的组分是 ___________ (填化学式),判断理由是 ___________ 。 为阿伏加德罗常数的值。该化合物的化学式为
为阿伏加德罗常数的值。该化合物的化学式为___________ ,B 原子的坐标为___________ ,该晶体的密度为___________ g⋅cm-3(写出表达式即可)。
(1)B、C、D中第一电离能从大到小的顺序是
(2)E的价层电子轨道表示式为
(3)这些元素形成的含氧酸中,酸根离子呈三角锥形结构的酸是
(4)这五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构如图1所示。该化合物中阴离子为
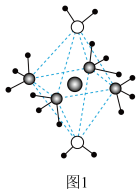
 为阿伏加德罗常数的值。该化合物的化学式为
为阿伏加德罗常数的值。该化合物的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】已知a~f是原子序数依次增大前四周期的六种元素,a元素原子核外电子只有一种自旋取向;b元素原子最高能级的不同轨道都有电子且自旋方向相同;c元素原子的价层电子排布为 ,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用
,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号 表示):
(1)e元素基态原子占据的最高能级共有_________ 个原子轨道,其形状是_________ ;f元素位于周期表的_________ 区,其基态原子的电子排布式为_________ 。
(2)a、b、c三种元素的电负性由大到小的顺序为_________ 。
(3)b、c、d、e四种元素的第一电离能由大到小的顺序为_________ 。
(4)下图是a~f中某种元素的部分电离能,由此判断该元素是_________ 。
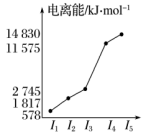
表1:Mn、Fe的部分电离能
(5)比较表1中Mn、Fe两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子
再失去一个电子_________ (填“易”或“难”)。你的解释是_________ 。
 ,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用
,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用(1)e元素基态原子占据的最高能级共有
(2)a、b、c三种元素的电负性由大到小的顺序为
(3)b、c、d、e四种元素的第一电离能由大到小的顺序为
(4)下图是a~f中某种元素的部分电离能,由此判断该元素是

表1:Mn、Fe的部分电离能
| 元素 | Mn | Fe | |
电离能/kJ·mol |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子
再失去一个电子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子在周期表的位置为___________ 。橄榄石中,各元素电负性由大到小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有___________ 个Mg。该物质化学式为___________ ,B—B最近距离为___________ 。
(1)基态Fe原子在周期表的位置为
(2)已知一些物质的熔点数据如下表:
| 物质 | 熔点/℃ |
| NaCl | 800.7 |
| SiCl4 | -68.8 |
| GeCl4 | -51.5 |
| SnCl4 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式:________________ 。
(2)用电子排布图表示D元素原子的价电子:__________ 。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____ C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________ 。
(1)写出C元素基态原子的电子排布式:
(2)用电子排布图表示D元素原子的价电子:
(3)元素B与D的电负性的大小关系是B
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式
您最近一年使用:0次



