2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)等物质的量的CH3CN和CO中,π键数目之比___________ 。
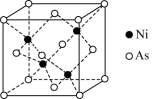
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。
(1)Li、P、S三种元素中,电负性最小的是
(2)基态As原子的电子排布式为
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)等物质的量的CH3CN和CO中,π键数目之比
(6)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρg/cm3,则该晶胞中最近的砷原子之间的距离为

更新时间:2023-05-21 16:56:40
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】I.快离子导体是一类具有优良离子导电能力的固体电解质,研究得最多的是Ag、Cu、Li、Na、F、O等的快离子导体。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中_____ 轨道上的电子。
(2)N、O、F的第一电离能从小到大的顺序为______ (用元素符号表示);NH3、H2O、HF的沸点由低到高的顺序为_____ (用化学式表示,下同),其中NH3、H2O的键角由小到大的顺序为_____ 。
(3)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图,1mol该配合物中所含的配位键为____ mol。

II.碳及其化合物广泛存在于自然界中,回答下列问题:
(4)基态碳原子的价电子轨道表示式是______ 。
a.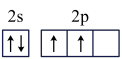 b.
b.
请阐述其原因是______ 。处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____ 形象地描述。在基态14C原子中,核外存在_____ 对自旋相反的电子。
(5)碳在形成化合物时,其键型以共价键为主,原因是______ 。写出两个与CS2互为等电子体的分子或离子______ 。
(6)甲醚(CH3OCH3)中氧原子的杂化方式为______ ,甲醚的沸点比乙醇(CH3CH2OH)的沸点_____ 。
(1)Cu-e-=Cu+的过程中,失去的电子是基态Cu中
(2)N、O、F的第一电离能从小到大的顺序为
(3)二乙二胺合铜配离子{[Cu(H2NCH2CH2NH2)2]2+}的结构如图,1mol该配合物中所含的配位键为

II.碳及其化合物广泛存在于自然界中,回答下列问题:
(4)基态碳原子的价电子轨道表示式是
a.
 b.
b.
请阐述其原因是
(5)碳在形成化合物时,其键型以共价键为主,原因是
(6)甲醚(CH3OCH3)中氧原子的杂化方式为
您最近一年使用:0次
【推荐2】在短周期主族元素中:
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________ (填元素名称)。
(2)铝是活泼的金属元素,单质铝由于___________ ,而具有良好的抗腐蚀能力,美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律。例如:Al13与卤素具有相似的化学性质,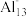 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与________ 族元素相似。
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式____________ ,乙元素的原子结构示意图________________ 。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________ 晶体,其化学式为_______________ 。
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是
(2)铝是活泼的金属元素,单质铝由于
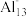 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
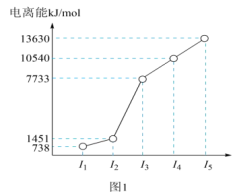
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素原子核外有___________ 种不同运动状态的电子,最高正化合价为___________ 。
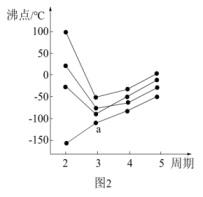
(2)如图2所示,每条折线表示周期表第IVA~VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ 。
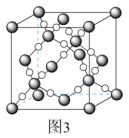
(3) 在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___________ 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有___________ 种。
(5)工业上用萤石(主要成分CaF2)制备HF。CaF2晶体的一种立方晶胞如图所示。

①CaF2晶体中距离Ca2+最近的F-有___________ 个。
②晶体中Ca2+与F-的最近距离为d nm,阿佛加德罗常数值为NA。该晶体的密度___________ g/cm3(列出计算式)。
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素原子核外有

(2)如图2所示,每条折线表示周期表第IVA~VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)
 在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于
(4)第一电离能介于Al、P之间的第三周期元素有
(5)工业上用萤石(主要成分CaF2)制备HF。CaF2晶体的一种立方晶胞如图所示。

①CaF2晶体中距离Ca2+最近的F-有
②晶体中Ca2+与F-的最近距离为d nm,阿佛加德罗常数值为NA。该晶体的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________ 。
(2)NH3分子的立体构型为_________ ,中心原子的杂化类型是_________ 。
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________ ,电负性最小的是_________ 。(填元素符号)
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________ 。
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有_________ 个,阿伏加 德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3
(1)基态铜原子的价电子排布式为
(2)NH3分子的立体构型为
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】金属锂及其化合物因独特的性质而具有重要的应用价值。例如:锰酸锂可用于电池; Li2O 可用于特种玻璃、陶瓷、医药等领域: LiH、LiBH4、LiNH2为常见的储氢材料等。回答下列问题:
(1)Mn2+最外层电子排布式___________
(2)LiH、LiBH4、 LiNH2中所含非金属元素的电负性由小到大的顺序为___________ (用元素符号表示); LiBH4中阴离子的空间构型为___________
(3)Li2O的熔点(1567℃)高于LiCl的熔点(605℃)的原因是___________ 。
(4)Li2O立方晶胞结构如图所示,晶胞边长为anm。Li+在晶胞中的配位数为___________ ;Li+和O2-的最短距离为___________ nm。

(1)Mn2+最外层电子排布式
(2)LiH、LiBH4、 LiNH2中所含非金属元素的电负性由小到大的顺序为
(3)Li2O的熔点(1567℃)高于LiCl的熔点(605℃)的原因是
(4)Li2O立方晶胞结构如图所示,晶胞边长为anm。Li+在晶胞中的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】硼及其化合物是用途广泛的化工原料,可以应用于新型材料的制备。回答下列问题:
(1)基态硼原子的价电子排布式为___________ ;与硼同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________ 。
(2)碳化硼(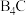 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于___________ 晶体。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)自然界中含硼钠盐是一种天然矿藏,其化学式为 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填标号)。
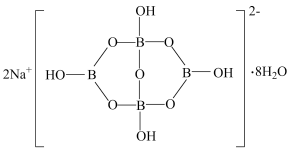
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4) 的空间构型为
的空间构型为___________ , 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因___________ 。
(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有___________ ,组成该有机物的第二周期元素电负性由大到小的顺序为___________ 。

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为___________ (填标号)。

②若晶胞的边长为apm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
(1)基态硼原子的价电子排布式为
(2)碳化硼(
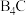 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)自然界中含硼钠盐是一种天然矿藏,其化学式为
 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)
 的空间构型为
的空间构型为 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为

②若晶胞的边长为apm,阿伏加德罗常数的值为
 ,则晶体的密度为
,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】回答下列问题:
(1) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为_______ ,其中 的配位数为
的配位数为_______ 。
(2) 中,电负性最高的元素是
中,电负性最高的元素是_______ ;P的_______ 杂化轨道与O的 轨道形成
轨道形成_______ 键。
(3) 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
(1)
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为 的配位数为
的配位数为(2)
 中,电负性最高的元素是
中,电负性最高的元素是 轨道形成
轨道形成(3)
 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】金属铁、铜、锌及其化合物在人类生产生活中起着重要作用.结合信息回答下列问题:
Ⅰ.在 催化作用下可利用
催化作用下可利用 制备甲酸
制备甲酸
(1)基态 原子的外围电子排布式为
原子的外围电子排布式为____________________________________ ;
(2) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为____________ ,分子中σ键和π键数目之比为____________ ;
(3)键角比较:
____________ (填“>”“<”或“=”) ;
;
(4)一种 的立方晶胞如图所示.
的立方晶胞如图所示.

① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为____________ .
②设晶胞边长为 ,
, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为____________  .
.
Ⅱ.工业中可利用生产钛白的副产物 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉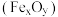 和硫酸,实现能源及资源的有效利用,
和硫酸,实现能源及资源的有效利用, 的结构示意图如图.
的结构示意图如图.

(5) 晶体中
晶体中 与
与 的作用力类型是
的作用力类型是____________ , 的空间构型为
的空间构型为____________ .
Ⅰ.在
 催化作用下可利用
催化作用下可利用 制备甲酸
制备甲酸(1)基态
 原子的外围电子排布式为
原子的外围电子排布式为(2)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为(3)键角比较:

 ;
;(4)一种
 的立方晶胞如图所示.
的立方晶胞如图所示.
①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为
 ,
, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 .
.Ⅱ.工业中可利用生产钛白的副产物
 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉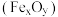 和硫酸,实现能源及资源的有效利用,
和硫酸,实现能源及资源的有效利用, 的结构示意图如图.
的结构示意图如图.
(5)
 晶体中
晶体中 与
与 的作用力类型是
的作用力类型是 的空间构型为
的空间构型为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】碱式碳酸铜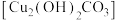 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.配制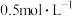 CuSO4溶液和
CuSO4溶液和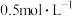 Na2CO3溶液各500 mL
Na2CO3溶液各500 mL
Ⅱ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅲ.探究反应的温度
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅳ.碱式碳酸铜的制备
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的___________ (填仪器名称),还需要补充的玻璃仪器是___________ 。(填仪器名称)___________ ;反应产生“绿色沉淀”碱式碳酸铜的离子反应方程式为___________ 。
(3)步骤Ⅱ中产生蓝色沉淀的成分是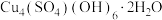 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是___________ 。
(4)步骤Ⅲ中反应的最适宜温度应为___________ ,“实验组⑧”中产物沉淀“绿色偏暗”的原因可能是___________ 。
(5)步骤Ⅳ中检验沉淀是否洗净的操作为___________ 。
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为___________ (已知 ,
, )。
)。
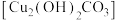 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:Ⅰ.配制
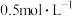 CuSO4溶液和
CuSO4溶液和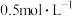 Na2CO3溶液各500 mL
Na2CO3溶液各500 mLⅡ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ① | ② | ③ | ④ |
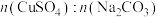 | 1:0.8 | 1:1 | 1:1.2 | 1:1.4 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 0.501 | 0.428 | 0.549 | 0.527 |
| 沉淀颜色 | 蓝色 | 蓝色 | 绿色 | 绿色 |
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ⑤ | ⑥ | ⑦ | ⑧ |
| 温度/℃ | 25 | 65 | 75 | 85 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 无 | 1.303 | 1.451 | 1.28 |
| 沉淀颜色 | 蓝色 | 绿色 | 绿色 | 绿色(偏暗) |
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制
 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的

(3)步骤Ⅱ中产生蓝色沉淀的成分是
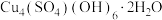 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是(4)步骤Ⅲ中反应的最适宜温度应为
(5)步骤Ⅳ中检验沉淀是否洗净的操作为
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为
 ,
, )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(Ni0.1Co0.9P)。回答下列问题:
(1)Co在元素周期表中的位置为___________ ,Co2+价层电子排布式为___________ 。
(2) Co、 Ni可形成[Co(NH3)6]Cl2、K3[Co(NO3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO 的空间构型为
的空间构型为___________ ,NO 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为___________ 。
②C、N、O、S四种元素中,电负性最大的是___________ 。
③1mol[Co(NH3)6]Cl2中含有σ键的数目为___________ ;已知NF3比NH3的沸点小得多,试解释原因___________ 。
(3)常用丁二酮肟来检验Ni2+,反应如下:

①1mol二(丁二酮肟)合镍(Ⅱ)中含有___________ mol配位键。
②上述反应的适宜pH为___________ (填字母序号)。
A.12 B.5~10 C.1
(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρg•cm-3,计算晶体晶胞的边长___________ cm。

(1)Co在元素周期表中的位置为
(2) Co、 Ni可形成[Co(NH3)6]Cl2、K3[Co(NO3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO
 的空间构型为
的空间构型为 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为②C、N、O、S四种元素中,电负性最大的是
③1mol[Co(NH3)6]Cl2中含有σ键的数目为
(3)常用丁二酮肟来检验Ni2+,反应如下:

①1mol二(丁二酮肟)合镍(Ⅱ)中含有
②上述反应的适宜pH为
A.12 B.5~10 C.1
(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρg•cm-3,计算晶体晶胞的边长

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】美国医学家证实了三价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的电子排布式为____________ 。
(2)O、N、S、Cr的第一电离能由大到小的顺序为_______________________ 。
(3)SO2分子的空间构型为________ , 中心原子的杂化方式为
中心原子的杂化方式为____________ 。
(4)CO2分子立体构型的为_________________ ,它的等电子体中属于分子的有________________ (任写一种)。
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为____________ ,配位数为_______________ 。
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加 德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为_____________________ pm。

(1)Cr的电子排布式为
(2)O、N、S、Cr的第一电离能由大到小的顺序为
(3)SO2分子的空间构型为
 中心原子的杂化方式为
中心原子的杂化方式为(4)CO2分子立体构型的为
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·2H2O,该物质配离子中提供孤电子对的原子为
(6)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加 德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞的棱长为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷汉和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。
①基态Co原子核外价电子排布图为___ ;
②基态氧原子中,电子占据的最高能层符号为___ ;该能层能量最高的能级电子云在空间有___ 个伸展方向。
(2)[Co(NO3)4]2-的配体中N原子的杂化方式为___ ,写出一种与NO 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为___ ,1mol该配离子中含σ键数目为___ NA。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
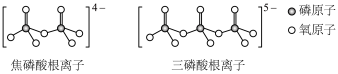
这类磷酸根离子的化学式可用通式表示为____ (用n代表P原子数)。
(4)①Li2O被广泛用作玻璃的组分,其熔点高于Na2O,原因是___ 。
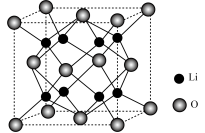
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为anm,NA为阿伏加 德罗常数的值,则Li2O的密度为___ g·cm−3。
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。
①基态Co原子核外价电子排布图为
②基态氧原子中,电子占据的最高能层符号为
(2)[Co(NO3)4]2-的配体中N原子的杂化方式为
 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为
(4)①Li2O被广泛用作玻璃的组分,其熔点高于Na2O,原因是
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为anm,NA为阿伏加 德罗常数的值,则Li2O的密度为

您最近一年使用:0次



