1 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④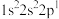 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④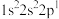 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近一年使用:0次
2024-01-24更新
|
141次组卷
|
7卷引用:天津市河北区2020-2021学年高二上学期期末检测化学试题
解题方法
2 . 下列各项叙述中,正确的是
| A.电负性:S>As>Se | B.键角:H2O<NH3<CH4 |
| C.沸点:HF>HCl>HBr>HI | D.离子还原性:S2->I->Br->Cl- |
您最近一年使用:0次
名校
解题方法
3 . 现有四种元素基态原子的电子排布式如下。则下列比较正确的是
①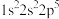 ;②
;② ;③
;③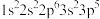 ;④
;④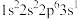
①
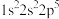 ;②
;② ;③
;③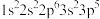 ;④
;④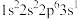
| A.第一电离能:③>①>④ | B.离子半径:④>①>② |
| C.电负性:①>②>④ | D.最高正化合价:①=③>④ |
您最近一年使用:0次
2022-09-02更新
|
685次组卷
|
7卷引用:天津市第一中学2020-2021学年高二下学期期中考试化学试题
解题方法
4 . 短周期元素 、
、 、
、 、
、 、
、 在元素周期表中相对位置如图所示。请用
在元素周期表中相对位置如图所示。请用化学用语 回答下列问题:
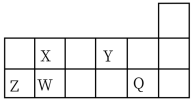
(1) 、
、 的离子半径由大到小的顺序为
的离子半径由大到小的顺序为_______ ; 、
、 、
、 元素的电负性最大的是
元素的电负性最大的是_______ 。
(2)下列说法正确的是_______
a. 和
和 都能溶于水生成对应的酸
都能溶于水生成对应的酸
b. 的含氧酸的酸性比
的含氧酸的酸性比 的含氧酸的酸性强
的含氧酸的酸性强
c. 的最简单气态氢化物的稳定性大于
的最简单气态氢化物的稳定性大于 的最简单气态氢化物的稳定性
的最简单气态氢化物的稳定性
d. 由 溶液分别滴入
溶液分别滴入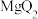 、
、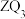 溶液中的反应现象可比较
溶液中的反应现象可比较 和
和 金属性的强弱
金属性的强弱
(3) 与
与 两元素的单质反应生成
两元素的单质反应生成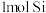 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热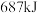 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为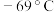 和
和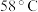 。写出该反应的热化学方程式
。写出该反应的热化学方程式_______ 。
(4)自来水厂用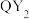 对饮用水进行消毒,处理后的水中要求
对饮用水进行消毒,处理后的水中要求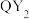 浓度在
浓度在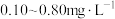 之间。碘量法可以检测水
之间。碘量法可以检测水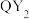 的浓度,步骤如下:
的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用 溶液调至中性,并加入淀粉溶液,溶液变蓝。
溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的 溶液。(已知:
溶液。(已知: )
)
操作Ⅲ:然后再加硫酸调节水样 至1~3。
至1~3。
操作时,不同 环境中
环境中 元素粒子种类及化合价如图所示:
元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是_______ 。
②确定操作II完全反应的现象是_______ 。
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是_______ 。
 、
、 、
、 、
、 、
、 在元素周期表中相对位置如图所示。请用
在元素周期表中相对位置如图所示。请用
(1)
 、
、 的离子半径由大到小的顺序为
的离子半径由大到小的顺序为 、
、 、
、 元素的电负性最大的是
元素的电负性最大的是(2)下列说法正确的是
a.
 和
和 都能溶于水生成对应的酸
都能溶于水生成对应的酸b.
 的含氧酸的酸性比
的含氧酸的酸性比 的含氧酸的酸性强
的含氧酸的酸性强c.
 的最简单气态氢化物的稳定性大于
的最简单气态氢化物的稳定性大于 的最简单气态氢化物的稳定性
的最简单气态氢化物的稳定性d. 由
 溶液分别滴入
溶液分别滴入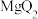 、
、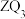 溶液中的反应现象可比较
溶液中的反应现象可比较 和
和 金属性的强弱
金属性的强弱(3)
 与
与 两元素的单质反应生成
两元素的单质反应生成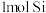 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热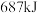 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为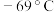 和
和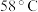 。写出该反应的热化学方程式
。写出该反应的热化学方程式(4)自来水厂用
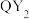 对饮用水进行消毒,处理后的水中要求
对饮用水进行消毒,处理后的水中要求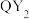 浓度在
浓度在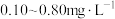 之间。碘量法可以检测水
之间。碘量法可以检测水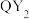 的浓度,步骤如下:
的浓度,步骤如下:操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用
 溶液调至中性,并加入淀粉溶液,溶液变蓝。
溶液调至中性,并加入淀粉溶液,溶液变蓝。操作Ⅱ:再加入一定量的
 溶液。(已知:
溶液。(已知: )
)操作Ⅲ:然后再加硫酸调节水样
 至1~3。
至1~3。操作时,不同
 环境中
环境中 元素粒子种类及化合价如图所示:
元素粒子种类及化合价如图所示:
①操作I中反应的离子方程式是
②确定操作II完全反应的现象是
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
5 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比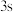 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比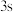 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
名校
6 . 下列说法正确的是
| A.电负性:Se>As | B.离子半径:Na+>Cl− |
| C.第一电离能:Al>Mg | D.键长:Cl−Cl>Br−Br |
您最近一年使用:0次
2022-01-07更新
|
488次组卷
|
6卷引用:天津市南开区2021-2022学年高三上学期期末考试化学试卷
名校
解题方法
7 . 电负性越大,元素的非金属性越强,第一电离能也越大。(____)
您最近一年使用:0次
2021-12-03更新
|
649次组卷
|
7卷引用:天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题
天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)人教2019选择性必修2第一章第二节 原子结构与元素的性质课后习题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修2(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
8 . 如图为长式周期表的一部分,其中的编号代表对应的元素。
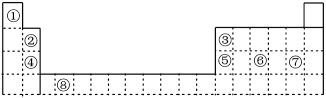
请回答下列问题:
(1)表中属于d区元素的是___ (填元素符号)。
(2)⑧的基态原子最高能层的电子占据能级的电子云轮廓图为___ 。
(3)下列③原子电子排布图表示的状态中,能量最高的为___ (填选项字母)。
(4)元素④的第一电离能___ 元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性___ 元素⑦(选填“>”、“ = ”或“<”)的电负性。
(5)⑥和⑦的最高价氧化物对应的水化物酸性强弱比较___ >___ (填分子式)。
(6)某些不同族元素的性质也有一定的相似性,如表中元素②与元素⑤的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式___ 。
(7)铟(In)与③同主族,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是___ 。

请回答下列问题:
(1)表中属于d区元素的是
(2)⑧的基态原子最高能层的电子占据能级的电子云轮廓图为
(3)下列③原子电子排布图表示的状态中,能量最高的为
A.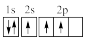 | B.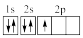 | C. | D.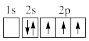 |
(5)⑥和⑦的最高价氧化物对应的水化物酸性强弱比较
(6)某些不同族元素的性质也有一定的相似性,如表中元素②与元素⑤的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(7)铟(In)与③同主族,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是
您最近一年使用:0次
9 . 完成下列问题。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:___________<x(Mg)<___________。___________
(2)指出下列两种化合物中氧元素的化合价:HClO___________ ,HFO___________ 。有机物结构式为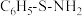 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向___________ 。
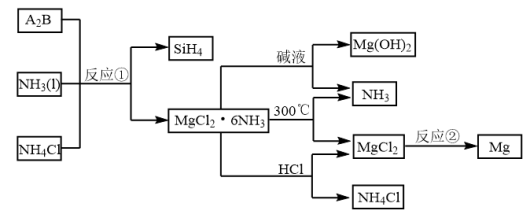
(3)成键的两原子相应元素x数值的差值为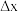 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是___________ 。
(4)预测元素周期表中,x值最小的元素位于___________ 周期___________ 族(放射性元素除外)。
Ⅱ.下图中反应①是制备 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
(5)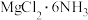 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):___________ 。
(6)A2B的化学式为___________ 。上图中可以循环使用的物质有___________ (化学式)。
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料___________ 。
(8)为实现燃煤脱硫,煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:___________ 。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | N | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.0 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)指出下列两种化合物中氧元素的化合价:HClO
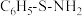 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向(3)成键的两原子相应元素x数值的差值为
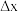 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是(4)预测元素周期表中,x值最小的元素位于
Ⅱ.下图中反应①是制备
 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
(5)
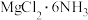 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):(6)A2B的化学式为
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(8)为实现燃煤脱硫,煤中加入浆状
 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:
您最近一年使用:0次
解题方法
10 . 元素X、Y、Z、T、R的原子序数依次增大且小于20,其最外层电子数与原子半径间大大小关系如图所示。
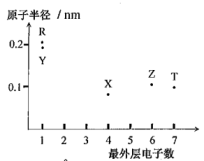
请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:_______ 。
(2)上述五种元素中,电负性最大的是(写元素符号,下同)_______ ,第一电离能最小的是_______ 。
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)_______ 。
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为_______ 。
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:_______ 。通过观察现象得出的结论:相同条件下,同主族元素R的金属性比Y的强。
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:_______ 。欲观察到现象为:_______ ;结论:_______ 。

请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:
(2)上述五种元素中,电负性最大的是(写元素符号,下同)
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:
您最近一年使用:0次



