名校
1 . Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.此化学方程式中涉及的第二周期元素的电负性大小的顺序为O<N<C |
B.配合物K4Fe(CN)6的中心离子的价电子排布图为 ,该中心离子的配位数是10 ,该中心离子的配位数是10 |
| C.1mol[Fe(CN)6]4-分子中含有σ键的数目为12×6.02×1023 |
| D.K2CO3中阴离子的空间构型为三角锥形,其中碳原子的价层电子对数为4 |
您最近一年使用:0次
名校
解题方法
2 . 下列事实的解释不正确的是
| 事实 | 解释 | |
| A |  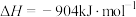 在任何温度均可自发进行 在任何温度均可自发进行 | 该反应为气体物质的量增大的反应,即 ,同时该反应为放热反应,根据 ,同时该反应为放热反应,根据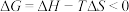 时反应可自发进行知,该反应在任意温度下都能自发进行 时反应可自发进行知,该反应在任意温度下都能自发进行 |
| B |  中 中 键角比 键角比 中的大 中的大 |  的中心原子的孤电子对数为1, 的中心原子的孤电子对数为1, 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力 |
| C | 热稳定性: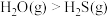 |  分子间能形成氢键 分子间能形成氢键 |
| D | 酸性: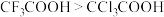 | 氟的电负性大于氯的电负性, 的极性大于 的极性大于 的极性,使 的极性,使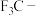 的极性大于 的极性大于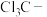 的极性,导致· 的极性,导致· 的羧基中的羟基的极性更大,更易电离出 的羧基中的羟基的极性更大,更易电离出 相对更小 相对更小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)用“>”或“<”填空:
第一电离能:P___________ S,离子半径:O2___________ Na+, 酸性:H2SO4 ___________ HClO4,电负性:Si___________ O。
(6)天然碱的主要成分为 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol  放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)用“>”或“<”填空:
第一电离能:P
(6)天然碱的主要成分为
 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
4 . 我国正在建造第四艘航空母舰,镍铬钢抗腐蚀性能强,可用于建造航母。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态 原子的价电子排布式为
原子的价电子排布式为____________ ,基态 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为____________ 形,元素C、O、F的电负性由大到小的顺序为____________ 。
(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、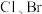 、I元素。
、I元素。
① 的空间构型为
的空间构型为____________ ,其中O原子杂化方式为____________ 杂化。
②海水综合利用中用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为____________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________ 。
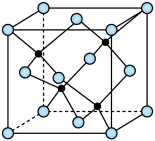
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
), 的配位数为
的配位数为____________ 。晶胞边长为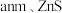 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________  。
。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态
 原子的价电子排布式为
原子的价电子排布式为 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、
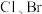 、I元素。
、I元素。①
 的空间构型为
的空间构型为②海水综合利用中用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。
 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
), 的配位数为
的配位数为 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 。
。
您最近一年使用:0次
解题方法
5 . 第三周期元素X、Y、Z的原子序数依次增大,25℃时,0.1mol/L它们最高价氧化物的水化物的溶液,对应的pH分别为13.00、1.57、0.70,下列有关说法正确的是
| A.原子半径:X<Y |
| B.元素电负性:Y<Z |
| C.Y的最高价氧化物的水化物属于强电解质 |
D.Z的最高价氧化物的水化物可能是 |
您最近一年使用:0次
名校
解题方法
6 . I.近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子简化的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的所在的原子轨道为_______ 形。与As位于同一周期,且未成对电子数也相同的元素有_______ (写元素符号)。
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为_______ ;BH 的空间构型为
的空间构型为_______ 。
(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为_______ 、_______ 。乙二胺能与Cu2+、Mg2+等金属离子形成稳定环状离子,其原因是_______ 。其中与乙二胺形成的化合物稳定性相对较高的是_______ (填Cu2+或Mg2+)。
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的_______ 区,Cu、Zn的第二电离能(I2):_______ >_______ 。
(5)下列状态的铜,电离最外层一个电子所需能量最大的是_______ 。
(6)Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如图步骤完成实验:
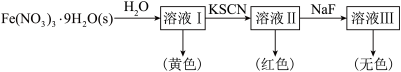
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有_______ molσ键;[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,其原因是_______ ,为了能观察到溶液I中[Fe(H2O)6]3+的浅紫色,可采取的方法是_______ 。
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,_______ 。
(1)基态砷原子简化的核外电子排布式为
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气:NaBH4+2H2O=NaBO2+4H2↑(反应前后B元素的化合价不变)。上述方程式中所涉及的元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为(3)乙二胺(H2NCH2CH2NH2)是一种有机物,分子中N原子、C原子的的杂化方式分别为
II.金属材料Fe、Cu、Zn等在工业生产和日常生活中有广泛的应用。
(4)黄铜是铜和锌组成的合金,铜、锌两种元素位于元素周期表的
(5)下列状态的铜,电离最外层一个电子所需能量最大的是
| A.[Ar]3d104s1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104p1 |

已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。
①1mol[Fe(H2O)6]3+中含有
②检验FeCl3溶液中含有Co2+的实验方法是:取FeCl3溶液于试管中,
您最近一年使用:0次
名校
7 . 胆矾CuSO4•5H2O可写[Cu(H2O)4]SO4•H2O,其结构示意图如图,下列有关胆矾的说法正确的是
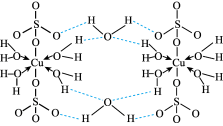

| A.所有氧原子都采取sp3杂化 |
| B.胆矾晶体中含有的粒子间的的作用有离子键、极性键、配位键、氢键4种化学键 |
| C.胆矾所含元素H、O、S的原子半径和电负性依次增大 |
| D.胆矾中的水在不同温度下会分步失去 |
您最近一年使用:0次
8 . 下列有关描述正确的是
A.键角:NH >H2S>H3O+ >H2S>H3O+ |
| B.酸性:CH3COOH<CH2ClCOOH<CHCl2COOH |
| C.电负性:Br>As>Se |
| D.沸点:CO<N2<HF |
您最近一年使用:0次
9 . 下列说法中,正确的是
| A.S区全部是金属元素 |
| B.第四周期元素中,未成对电子数最多的元素位于第VIB族 |
| C.第一电离能的大小可以作为判断元素金属性强弱的依据 |
| D.电负性大于1.8的一定是非金属,小于1.8的一定是金属 |
您最近一年使用:0次
真题
名校
10 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确 的是
A.第一电离能: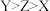 |
B.电负性: |
C.Z、W原子形成稀有气体电子构型的简单离子的半径: |
D. 与水反应生成产物之一是非极性分子 与水反应生成产物之一是非极性分子 |
您最近一年使用:0次
2023-06-21更新
|
8642次组卷
|
16卷引用:天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题
天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题天津市南开中学2023-2024学年高二下学期期中考试化学试卷2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用) 浙江省绍兴市诸暨市2023-2024学年高二上学期期末检测化学试题江苏省扬州中学2023-2024学年高二下学期3月考试化学试题江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题



