名校
解题方法
1 . C、N、P、Si是重要的非金属元素,在生产、生活中有重要应用。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为_______ 。
(3) 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______ 。
(4) 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为_______ ,分子的立体构型为三角双锥形, 属于
属于_______ 分子(填“极性”或“非极性”),其中心原子杂化类型为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释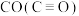 比
比 相对活泼的原因:
相对活泼的原因:_______ 。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
A.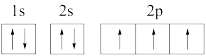 | B.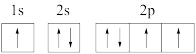 |
C.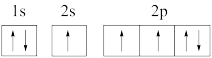 | D.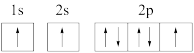 |
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为(3)
 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为(4)
 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为 属于
属于A.
 B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释
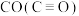 比
比 相对活泼的原因:
相对活泼的原因:| C—O | C=O |  | |
键能 | 357.7 | 798.9 | 1071.9 |
| N—N | N=N |  | |
键能 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
2022-08-21更新
|
352次组卷
|
2卷引用:山东省潍坊市2021-2022学年高二上学期期末考试化学试题
名校
2 . X、Y、Z、W、Q五种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为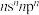 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
(1)W核外电子运动状态共有_______ 种。
(2)阴离子 、
、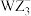 的空间构型分别是
的空间构型分别是_______ 、_______ 。
(3)基态Q原子中,核外电子占据最高能层的符号是_______ ,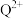 的价电子排布式为
的价电子排布式为_______ ,Q在周期表中的位置是_______ 区。
(4) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(5)Y与W可形成化合物 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W; 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断 可能的水解产物为
可能的水解产物为_______ (写化学式)。
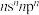 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。(1)W核外电子运动状态共有
(2)阴离子
 、
、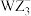 的空间构型分别是
的空间构型分别是(3)基态Q原子中,核外电子占据最高能层的符号是
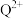 的价电子排布式为
的价电子排布式为(4)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为(5)Y与W可形成化合物
 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W; 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断 可能的水解产物为
可能的水解产物为
您最近一年使用:0次
2022-08-21更新
|
336次组卷
|
2卷引用:山东省潍坊市2021-2022学年高二上学期期末考试化学试题
解题方法
3 . 短周期主族元素W、X、Y、Z、M的原子序数逐渐增大,W、X、Y、Z四种元素形成化合物的结构如图所示。M是电负性最强的元素,W能与X、Y、Z形成电子数相等的分子, 常温下为液体。下列说法正确的是
常温下为液体。下列说法正确的是

 常温下为液体。下列说法正确的是
常温下为液体。下列说法正确的是
| A.简单气态氢化物稳定性:M>Z>Y | B.第一电离能:Z>Y>X |
C.键角: | D.该化合物分子中所有原子共平面 |
您最近一年使用:0次
4 . 下列关于B、S、C及其化合物的结构与性质的论述错误的是
| A.C的电负性比B大,则C、B形成的二元化合物中,C显负化合价 |
B. 和 和 中B、S杂化轨道类型相同,二者均为正三角形结构 中B、S杂化轨道类型相同,二者均为正三角形结构 |
C.常温下 为液体,说明 为液体,说明 是非极性分子 是非极性分子 |
D.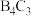 的硬度可与金刚石媲美,且熔点高,则 的硬度可与金刚石媲美,且熔点高,则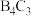 为共价晶体 为共价晶体 |
您最近一年使用:0次
名校
解题方法
5 . 二氯异氰尿酸钠是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,其合成方法如下图。下列说法错误的是
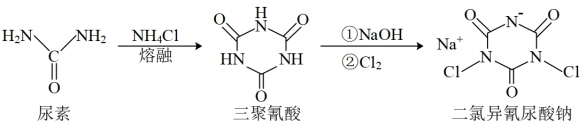

| A.尿素和氯化铵中N原子杂化方式相同 |
| B.二氯异氰尿酸钠所含元素中电负性最大的是氧 |
| C.二氯异氰尿酸钠晶体中存在离子键、共价键和配位键 |
D.三聚氰酸具有与苯环类似的结构,可推知三聚氰酸分子中存在大 键 键 |
您最近一年使用:0次
2022-04-08更新
|
673次组卷
|
5卷引用:山东省潍坊青州市2022届5月学业水平等级考试化学试题
名校
6 . 某科研团队研究用不同金属氧化物催化肉桂醛制苯甲醛(反应如下,部分产物略去)。反应时间和其它条件相同时,测得实验数据如下表。
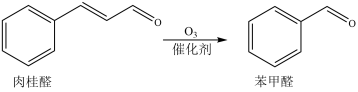
已知:i.选择性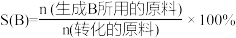
ii. 与
与 同主族。
同主族。
下列说法不正确 的是

| 催化剂 | 金属元素的电负性 | 肉桂醛转化率/% | 苯甲醛选择性/% |
 | 0.9 | 80.79 | 71.93 |
 | 1.0 | 78.27 | 60.51 |
 | 1.5 | 74.21 | 54.83 |
 | 1.6 | 76.46 | 48.57 |
 | 1.9 | 75.34 | 41.71 |
ii.
 与
与 同主族。
同主族。下列说法
| A.肉桂醛制苯甲醛的反应属于氧化反应 |
B.用 作催化剂可以获得比用 作催化剂可以获得比用 更大的主反应速率 更大的主反应速率 |
C.使用 作催化剂时,反应后副产物最多 作催化剂时,反应后副产物最多 |
| D.金属氧化物中金属元素的电负性越小,苯甲醛选择性越好 |
您最近一年使用:0次
2022-04-01更新
|
652次组卷
|
5卷引用:山东省潍坊市2022届高三下学期5月模拟考试(二)化学试题
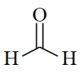
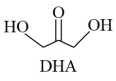
7 . 2021年9月24日《科学》杂志发表了我国科学家的原创性重大突破,首次在实验室实现从CO2到淀粉的全合成。其合成路线如下:
CO2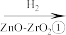 CH3OH
CH3OH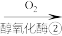
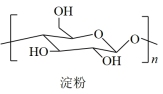
下列说法错误的是
CO2
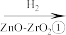 CH3OH
CH3OH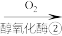

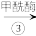


下列说法错误的是
| A.电负性:O>C>H>Zn |
| B.甲醇分子中H-C-O键角小于甲醛分子中H-C-O键角 |
| C.DHA分子间存在氢键 |
| D.Zn溶于氨水形成配合物[Zn(NH3)4](OH)2,Zn2+的配位数为6 |
您最近一年使用:0次
2022-03-04更新
|
944次组卷
|
3卷引用:山东省潍坊市2022届高三普通高等学校招生全国统一考试(一模)化学试题
山东省潍坊市2022届高三普通高等学校招生全国统一考试(一模)化学试题(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)新疆石河子第一中学2021-2022学年高二4月月考化学试题
名校
解题方法
8 . 现有四种元素的基态原子的核外电子排布式如下:①1s22s22p3;②1s22s22p4;③1s22s22p63s23p2;④1s22s22p63s23p3。下列说法错误的是
| A.电负性:②>①>④>③ |
| B.原子半径:③>④>①>② |
| C.第一电离能:②>①>④>③ |
| D.简单气态氢化物的稳定性:②>①>④>③ |
您最近一年使用:0次
2022-01-24更新
|
517次组卷
|
3卷引用:山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题
9 . N2F4可作高能燃料的氧化剂,它可由以下反应制得:HNF2+Fe3+→N2F4↑+Fe2++H+(未配平)。下列说法错误的是
| A.N2F4分子中N-F键键角小于N2H4分子中N-H键键角 |
| B.上述反应中,氧化剂与还原剂的物质的量之比为1:1 |
| C.若生成标准状况下2.24LN2F4,转移电子0.2mol |
| D.N2F4作氧化剂时,其还原产物可能是N2和HF |
您最近一年使用:0次
2021-12-21更新
|
664次组卷
|
7卷引用:山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题
山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 二轮专题突破 专题5 氧化还原反应的概念,规律及应用(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
10 . 光气(COCl2)是一种重要的有机中间体。可用反应CHCl3+H2O2=COCl2↑+HCl+H2O制备光气。下列叙述错误的是
| A.CHCl3为极性分子 |
| B.电负性:O>Cl>C |
C.基态Cl原子的价电子轨道表示式: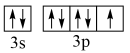 |
| D.COCl2中碳原子的杂化类型为sp3杂化 |
您最近一年使用:0次
2021-12-21更新
|
363次组卷
|
3卷引用:山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题
山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江苏省阜宁中学2022-2023学年高二上学期期中考试化学试题



