1 . 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)A、B、C、D四种元素的电负性从大到小的顺序为___________ (用元素符号表示);化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是___________ 。
(2)元素E能形成多种配合物,如: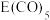 等。
等。
①基态E原子的价电子排布式为___________ 。
②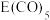 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断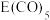 晶体属于
晶体属于___________ (填晶体类型),该晶体中E的化合价为___________ 。
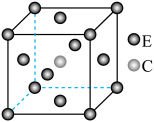
(3)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为___________ 。若两个最近的E原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是___________  。
。
(1)A、B、C、D四种元素的电负性从大到小的顺序为
 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是(2)元素E能形成多种配合物,如:
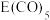 等。
等。①基态E原子的价电子排布式为
②
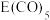 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断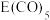 晶体属于
晶体属于(3)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为
 ,则该晶体的密度是
,则该晶体的密度是 。
。
您最近半年使用:0次
2 . 下列元素或化合物的性质变化顺序不正确的是
A.第一电离能: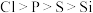 |
B.电负性: |
C.价层电子对互斥理论中, 键电子对数计入中心原子的价层电子对数 键电子对数计入中心原子的价层电子对数 |
| D.第四周期元素中,锰原子价电子层中未成对电子数最多 |
您最近半年使用:0次
3 . 化合物NaBH4和NaH与水的反应分别为①NaBH4+4H2O=Na[B(OH)4]+4H2↑;②NaH+H2O=NaOH+H2↑,下列说法错误的是
| A.电负性:H>B |
| B.①②中水均发生还原反应 |
| C.NaBH4和Na[B(OH)4]中提供孤电子对的均是氢原子 |
| D.当反应①、②转移的电子数相同时,产生H2的物质的量相等 |
您最近半年使用:0次
解题方法
4 . W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称______ ;Y元素的元素符号______ 。
(2)写出M元素+2价离子的价层电子排布式______ 。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为______ 。
(4)W、X、Z可形成强还原性物质ZXW4,W、X、Z三种元素电负性由大到小的顺序是______ (用元素符号表示)。
(5)中国的稀土储量世界第一、稀土元素是周期系ⅢB族中原子序数为21(Sc)、39(Y)和镧系元素共17种化学元素的统称。其中钪(Sc)元素有______ 种运动状态不同的电子,最高能层符号是______ ;稀土元素分组方法之一是两分法[轻稀土和重稀土]。两分法分组以Gd(钆)划界的原因是:从Gd之后在4f亚层上新增加电子的自旋方向改变了,则Gd的4f能级价层电子排布图为______ 。
元素 | 元素性质或原子结构 |
W | 电子只有一种自旋取向 |
X | 核外只有一个未成对电子,且电子有三种空间运动状态 |
Y | s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素 |
Z | 电负性是短周期中最小的 |
M | +3价基态离子最高能级处于半满状态 |
(1)写出X元素的名称
(2)写出M元素+2价离子的价层电子排布式
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为
(4)W、X、Z可形成强还原性物质ZXW4,W、X、Z三种元素电负性由大到小的顺序是
(5)中国的稀土储量世界第一、稀土元素是周期系ⅢB族中原子序数为21(Sc)、39(Y)和镧系元素共17种化学元素的统称。其中钪(Sc)元素有
您最近半年使用:0次
名校
解题方法
5 . X、Q、Y、Z、W、M、R、T是原子半径依次增大的前四周期元素,基态R原子核外电子有9种空间运动状态,并有2个单电子;基态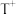 的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
(1)基态R原子的价电子排布式为_______ 的,第一电离能小于R的同周期元素有_______ 种。
(2) 的结构如图Ⅱ所示,分子中存在大
的结构如图Ⅱ所示,分子中存在大 键
键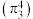 ,比较键长:①
,比较键长:①_______ ②(填“>”“<”或“=”),理由是_______ 。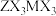 分子中M原子的杂化方式为
分子中M原子的杂化方式为_______ ,熔点比
_______ (填“高”或“低”); 中T的化合价为
中T的化合价为 ,且含有4个
,且含有4个 价的Y,则该分子中
价的Y,则该分子中 键与
键与 键的个数比为
键的个数比为_______ 。
(4)53号元素A的电负性与W近似相等,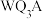 水解反应的产物为
水解反应的产物为_______ 。
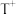 的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
(1)基态R原子的价电子排布式为
(2)
 的结构如图Ⅱ所示,分子中存在大
的结构如图Ⅱ所示,分子中存在大 键
键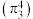 ,比较键长:①
,比较键长:①
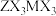 分子中M原子的杂化方式为
分子中M原子的杂化方式为
 中T的化合价为
中T的化合价为 ,且含有4个
,且含有4个 价的Y,则该分子中
价的Y,则该分子中 键与
键与 键的个数比为
键的个数比为(4)53号元素A的电负性与W近似相等,
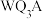 水解反应的产物为
水解反应的产物为
您最近半年使用:0次
2023-12-03更新
|
290次组卷
|
3卷引用:2024届山东省临沂市高三11月教学质量检测考试 化学
2024届山东省临沂市高三11月教学质量检测考试 化学四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
6 . 下列有关化合物结构与性质的论述错误的是
A.F的电负性大于Cl,因此 酸性强于 酸性强于 |
B.键能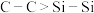 、 、 ,因此 ,因此 稳定性大于 稳定性大于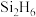 |
C. 的结构与苯相似,每个B、N各提供1个电子形成大 的结构与苯相似,每个B、N各提供1个电子形成大 键 键 |
| D.Si—C键的键长大于C—C键的键长,因此SiC的熔点和硬度低于金刚石 |
您最近半年使用:0次
解题方法
7 . 下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中 与 与 间的作用力大于碘晶体中分子间的作用力 间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比SnH4分子稳定性大 | Sn的原子半径比C的大,Sn与H之间的键能比C与H之间的键能小 |
| C | 酸性:三氟乙酸>三氯乙酸>乙酸 | 电负性:F>Cl>H |
| D | 邻羟基苯甲醛的熔沸点比对羟基苯甲醛的熔沸点高 | 邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
8 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为_____ 。
(2)Ga、As、Se的第一电离能由大到小的顺序是_____ ,Ga、As、Se的电负性由大到小的顺序是_____ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及其原因:_____ 。
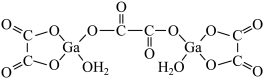
(4)二水合草酸镓的结构式如图所示,其中镓原子的配位数是_____ ,草酸根离子中的C原子杂化轨道类型是_____ 。
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及其原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |

您最近半年使用:0次
9 . 如表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。下列说法正确的是
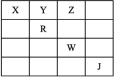

A.R原子的核外电子的轨道表示式为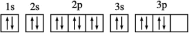 |
| B.Y2−与Na+的半径大小关系为Y2->Na+ |
| C.X的第一电离能小于Y的第一电离能 |
| D.表中电负性最大的元素为Z |
您最近半年使用:0次
10 . 下列说法不正确的是
| A.乙烯分子中的σ键和π键之比为5∶1 |
| B.某元素气态基态原子的逐级电离能(kJ∙mol−1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
| C.Na、P、Cl的电负性依次增大 |
D.三氧化硫有单分子气体和三聚分子固体(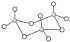 )两种存在形式,两种形式中S原子杂化轨道类型相同 )两种存在形式,两种形式中S原子杂化轨道类型相同 |
您最近半年使用:0次



