1 . 现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p3;④1s22s22p5
| A.第一电离能:④>③>②>① | B.原子半径:①>②>③>④ |
| C.未成对电子数:④>③=②>① | D.电负性:④>③>②>① |
您最近一年使用:0次
2024-03-15更新
|
198次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
2 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的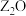 和黑色的
和黑色的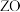 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。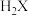 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)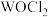 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向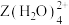 的溶液通入
的溶液通入 ,会生成
,会生成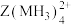 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的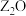 和黑色的
和黑色的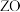 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是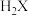 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
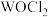 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
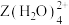 的溶液通入
的溶液通入 ,会生成
,会生成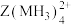 的原因是
的原因是
您最近一年使用:0次
3 .  和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实不能 从元素的电负性角度解释的是
 和S均属于ⅥA族元素。下列事实
和S均属于ⅥA族元素。下列事实A.熔点: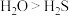 | B.还原性: |
C.沸点: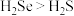 | D. 中H为+1价 中H为+1价 |
您最近一年使用:0次
2023-12-14更新
|
69次组卷
|
2卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 陈述Ⅰ和Ⅱ均正确﹐且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A. | 电负性:F>Cl | 酸性: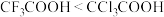 |
| B. | 分子极性: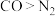 | 范德华力: |
| C. | 离子半径: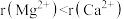 | 熔点:MgO>CaO |
| D. | 分子间作用力: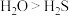 | 稳定性: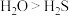 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-17更新
|
268次组卷
|
3卷引用:山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题
解题方法
5 . X、Y、Z为短周期主族元素,化合物 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是
 是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体
是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体 。下列说法正确的是
。下列说法正确的是A.电负性: 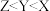 |
| B.基态Z原子和Y原子的未成对电子数相等 |
C. 的空间构型为三角锥形 的空间构型为三角锥形 |
D. 的分子中, 的分子中, 键与 键与 键个数比为2:1 键个数比为2:1 |
您最近一年使用:0次
2023-05-27更新
|
321次组卷
|
2卷引用:山东省潍坊市2023届高三下学期三模化学试题
名校
6 . 按照路易斯酸碱理论,在反应中接受电子对的物质为酸,在反应中给出电子对的物质为碱。酸可分为硬酸(半径小,电荷高)和软酸(半径大、电荷低),碱可以分为硬碱(给出电子对的原子电负性大)和软碱(给出电子对的原子电负性小)。软硬酸碱结合的原则是:软亲软,硬亲硬;软和硬,不稳定。下列微粒稳定性次序正确的是
A. | B. |
C.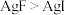 | D. |
您最近一年使用:0次
2023-05-18更新
|
340次组卷
|
3卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题
解题方法
7 . 一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是
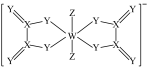
A.电负性: | B.简单氢化物的沸点: |
C.最高价氧化物对应水化物的酸性: | D.单质的氧化性: |
您最近一年使用:0次
名校
解题方法
8 . CuO在化学链(如气相烃类)燃烧和催化CO氧化过程中均展现出良好的性能,同时具有成本低廉的优势,有望成为贵金属催化剂的替代品。中国科学院工程热物理研究所的科研人员初步揭示了CO在CuO表面的催化机理,并深入研究了 在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
(1)基态铜原子的价电子排布式为___________ 。
(2)N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为___________ 。
(3)已知 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是___________ 。
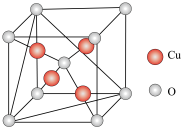
(4)铜的某种氧化物的晶胞结构如图所示,若该晶胞中 原子与O原子之间的最近距离为
原子与O原子之间的最近距离为 ,设阿伏加德罗常数的值为NA,则该晶胞的密度为
,设阿伏加德罗常数的值为NA,则该晶胞的密度为___________  (填含a、NA的代数式)。
(填含a、NA的代数式)。
 在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。
在铜基氧化物表面的反应机制,并提出了对应的反应动力学模型。(1)基态铜原子的价电子排布式为
(2)N与C、O同周期,H、C、N三种元素的电负性从小到大的顺序为
(3)已知
 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是(4)铜的某种氧化物的晶胞结构如图所示,若该晶胞中
 原子与O原子之间的最近距离为
原子与O原子之间的最近距离为 ,设阿伏加德罗常数的值为NA,则该晶胞的密度为
,设阿伏加德罗常数的值为NA,则该晶胞的密度为 (填含a、NA的代数式)。
(填含a、NA的代数式)。
您最近一年使用:0次
名校
9 . 化合物R是一种用于有机合成的催化剂,其网状结构片段如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素原子序数之和为29,W的第一电离能大于同周期相邻元素。下列说法正确的是
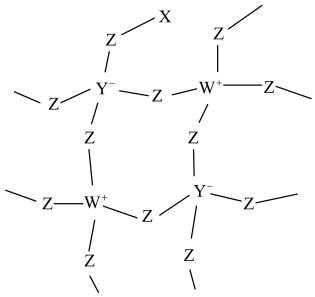

A.电负性: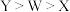 |
B.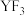 中各原子均满足8电子稳定结构 中各原子均满足8电子稳定结构 |
| C.同周期元素形成的单质中,Z的氧化性最强 |
D.化合物 中Y、Z、W原子的杂化类型相同 中Y、Z、W原子的杂化类型相同 |
您最近一年使用:0次
名校
解题方法
10 . W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称_______ 。
(2)写出M元素+2价离子的价电子轨道表示式_______ 。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为_______ 。
(4)W、X、Z可形成强还原性物质 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(5)大π键可用符号 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作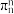 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键_______ ,某化合物XY的结构(见下图b)中也存在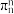 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因_______ 。

| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 核外只有一个未成对电子,且电子有三种空间运动状态 |
| Y | s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素 |
| Z | 电负性是短周期中最小的 |
| M | +3价基态离子最高能级处于半满状态 |
(1)写出X元素的名称
(2)写出M元素+2价离子的价电子轨道表示式
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为
(4)W、X、Z可形成强还原性物质
 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是(5)大π键可用符号
 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作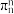 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键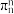 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
您最近一年使用:0次
2023-02-23更新
|
643次组卷
|
2卷引用:山东省潍坊市2022-2023学年高二上学期期末考试化学试题



