1 . 短周期元素可形成许多结构和性质不同的化合物,回答下列问题:

(1)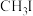 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
;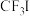 的水解产物为
的水解产物为_____ (填化学式)。
(2) 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体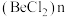 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为_____ 。
(3)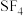 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断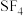 应采用结构
应采用结构_____ (填“a”或“b”)。
(4)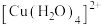 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了_____ (填化学式),比较它与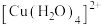 的稳定性并说明理由
的稳定性并说明理由_____ 。
(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对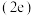 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对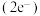 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了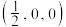 、
、 ,还有
,还有_____ ;若晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
_____  (用含
(用含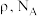 的代数式表示)。
的代数式表示)。


(1)
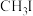 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
;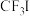 的水解产物为
的水解产物为(2)
 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体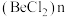 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为(3)
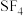 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断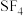 应采用结构
应采用结构(4)
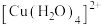 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了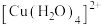 的稳定性并说明理由
的稳定性并说明理由(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了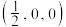 、
、 ,还有
,还有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
 (用含
(用含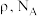 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 下列关于物质结构和性质的说法正确的是
A.第2周期元素中,第一电离能介于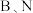 之间的有1种 之间的有1种 |
B.酸性: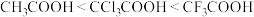 |
C. 与 与 中心原子的杂化方式相同,均为 中心原子的杂化方式相同,均为 形结构 形结构 |
D.乙二胺 的沸点比三甲胺 的沸点比三甲胺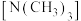 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 |
您最近一年使用:0次
2024-03-21更新
|
592次组卷
|
4卷引用:山东省菏泽市2024届高三一模考试化学试题
山东省菏泽市2024届高三一模考试化学试题山东省滕州市第一中学2023-2024学年高二下学期3月月考化学试题(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
名校
解题方法
3 . 三星堆遗址出土了大量的青铜器,其主要成分为Cu、Sn、Pb,还含少量Fe、As、O等元素。对上述有关元素,下列说法正确的是
A.基态Cu原子的价层电子轨道表示式为 |
| B.基态Fe原子最高能级的轨道形状为哑铃形 |
| C.第一电离能最大的是As |
| D.电负性最大的是O |
您最近一年使用:0次
2023-03-31更新
|
510次组卷
|
3卷引用:山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
4 . 莫那比拉韦(X),又称为EIDD-2801/MK4482,是核苷类似物β-d-N4-羟基胞苷(Y)的异丙酯前药,可抑制多种RNA病毒的复制。下列说法中错误的是
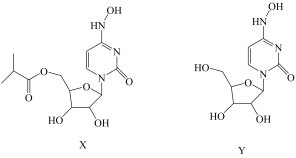
| A.Y可与水分子形成氢键 |
| B.X分子中含有5个手性碳原子 |
| C.X与Y所含元素中,电负性最大的是氧元素 |
D.X中C原子有 、 、 两种杂化方式 两种杂化方式 |
您最近一年使用:0次
2023-03-30更新
|
560次组卷
|
6卷引用:山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
5 . 在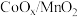 催化下醇的氧化氰化反应如图所示。下列叙述正确的是
催化下醇的氧化氰化反应如图所示。下列叙述正确的是

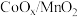 催化下醇的氧化氰化反应如图所示。下列叙述正确的是
催化下醇的氧化氰化反应如图所示。下列叙述正确的是
A.熔点: | B.键角: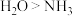 |
C.I和II分子中 键数目相同 键数目相同 | D.II含有的元素中 的电负性最大 的电负性最大 |
您最近一年使用:0次
2023-03-16更新
|
2415次组卷
|
4卷引用:山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
6 . 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是
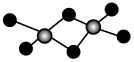

| 性质 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/℃ | 1290 | 192.4 | 97.8 | 189.4 |
| 沸点/℃ | 1272 | 180 | 256 | 382 |
| A.AlF3晶体类型与其他三种不同 |
| B.1molAl2Cl6中所含配位键数目为4NA |
| C.Al2X6中Al、X原子价电子层均满足8e-结构 |
| D.AlCl3熔点高于AlBr3原因是Cl的电负性大于Br,具有一定离子晶体特征 |
您最近一年使用:0次
2023-03-03更新
|
1375次组卷
|
9卷引用:山东省单县第二中学2023届高三下学期第1次 阶段性质量检测化学试题
山东省单县第二中学2023届高三下学期第1次 阶段性质量检测化学试题山东省淄博市2022-2023学年高三第一次模拟考试化学试题(已下线)专题06 物质结构与性质黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(普通班)化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期4月月考(实验班)化学试题辽宁省锦州市育明高级中学2022-2023学年高二下学期第一次阶段性考试化学试题辽宁省沈阳市东北育才学校(高中部)2022-2023学年高二下学期4月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期期中考试化学试题广东省东莞市东莞外国语学校2023-2024学年高二上学期11月期中化学试题
名校
7 . 有关周期表和周期律的说法正确的是
| A.周期表p区所有元素,电子最后填入的能级均为p能级 |
| B.第二周期元素,电离能介于B和N之间的元素有1种 |
| C.周期表第14列元素形成化合物种类最多 |
| D.同一周期,第ⅡA族元素电负性大于第ⅢA族元素 |
您最近一年使用:0次
2023-02-11更新
|
712次组卷
|
9卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题山东省济宁市2022-2023学年高二上学期期末考试化学试题天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题广东番禺中学2022-2023学年高二下学期4月期中考试化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷湖北省荆州市沙市中学2022-2023学年高二下学期2月月考化学试题
名校
解题方法
8 . Zn、V、Cu、In、S和Se等原子是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)49In的价层电子排布式为_______ 。
(2)Zn、O、S和Se的电负性由大到小的顺序为_______ 。制备荧光材料过程中会产生少量SO 、VO
、VO ,其中V原子采用
,其中V原子采用_______ 杂化,VO 空间结构为
空间结构为_______ ,SO 的空间构型为
的空间构型为_______ 。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______ ,其原因是_______ 。
(4)H、C、N、S四种元素可形成硫氰酸(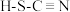 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为_______ ,异硫氰酸沸点较高,原因是_______ 。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为_______ 。
(1)49In的价层电子排布式为
(2)Zn、O、S和Se的电负性由大到小的顺序为
 、VO
、VO ,其中V原子采用
,其中V原子采用 空间结构为
空间结构为 的空间构型为
的空间构型为(3)C、N、S分别与H形成的简单氢化物中键角最小的是
(4)H、C、N、S四种元素可形成硫氰酸(
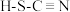 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次
名校
解题方法
9 . C、N、P、Si是重要的非金属元素,在生产、生活中有重要应用。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为_______ 。
(3) 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______ 。
(4) 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为_______ ,分子的立体构型为三角双锥形, 属于
属于_______ 分子(填“极性”或“非极性”),其中心原子杂化类型为_______ (填序号)。
A.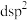 B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释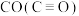 比
比 相对活泼的原因:
相对活泼的原因:_______ 。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
A.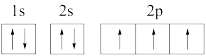 | B.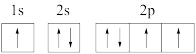 |
C.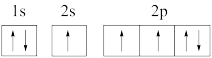 | D.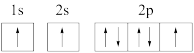 |
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为(3)
 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为(4)
 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为 属于
属于A.
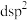 B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释
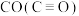 比
比 相对活泼的原因:
相对活泼的原因:| C—O | C=O |  | |
键能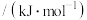 | 357.7 | 798.9 | 1071.9 |
| N—N | N=N |  | |
键能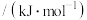 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
2022-08-21更新
|
352次组卷
|
2卷引用:山东省菏泽第一中学2022-2023学年高二上学期12月月考化学试题
名校
10 . X、Y、Z、W、Q五种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为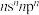 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
(1)W核外电子运动状态共有_______ 种。
(2)阴离子 、
、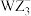 的空间构型分别是
的空间构型分别是_______ 、_______ 。
(3)基态Q原子中,核外电子占据最高能层的符号是_______ ,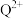 的价电子排布式为
的价电子排布式为_______ ,Q在周期表中的位置是_______ 区。
(4) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(5)Y与W可形成化合物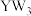 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W;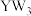 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断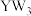 可能的水解产物为
可能的水解产物为_______ (写化学式)。
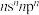 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。(1)W核外电子运动状态共有
(2)阴离子
 、
、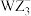 的空间构型分别是
的空间构型分别是(3)基态Q原子中,核外电子占据最高能层的符号是
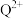 的价电子排布式为
的价电子排布式为(4)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为(5)Y与W可形成化合物
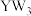 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W;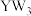 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断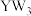 可能的水解产物为
可能的水解产物为
您最近一年使用:0次
2022-08-21更新
|
336次组卷
|
2卷引用:山东省菏泽第一中学2022-2023学年高二上学期12月月考化学试题



