2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
山东
高三
三模
2024-05-25
169次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质、有机化学基础
2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
山东
高三
三模
2024-05-25
169次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 中国古代诗词和书籍中蕴含着化学知识。下列说法错误的是
| A.“白玉金边素瓷胎,雕龙描凤巧安排”,瓷器是人类较早应用的人造硅酸盐材料 |
| B.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”含有胶体 |
| C.“九秋风露越窑开,夺得千峰翠色来”,“翠色”来自氧化亚铜 |
| D.镀金时“以汞和金涂银器上,入火则汞去,而金存”,其中“入火则汞去”指汞的挥发 |
【知识点】 胶体的定义及分类解读 硅酸盐工业的一般特点总结及判断解读
您最近一年使用:0次
2024-02-19更新
|
1050次组卷
|
5卷引用:重庆市荣昌中学校2023-2024学年高三下学期开学考试化学试题
重庆市荣昌中学校2023-2024学年高三下学期开学考试化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
容易(0.94)
解题方法
2. 实验室中下列做法正确的是
| A.用花生油萃取溴水中的溴 |
| B.汞大量洒落,必须尽可能收集,并深埋处理 |
| C.酸式滴定管用待装液润洗后,从滴定管上口倒出 |
| D.移取熔融氯化钠的坩埚,应用坩埚钳夹持 |
您最近一年使用:0次
2024-03-21更新
|
417次组卷
|
3卷引用:山东省菏泽市2024届高三一模考试化学试题
单选题
|
较易(0.85)
名校
解题方法
3. 下列描述原子结构的化学用语错误的是
A.基态铜原子的价层电子排布式: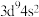 |
B. 的价电子排布图: 的价电子排布图: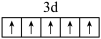 |
C.钛原子结构示意图为: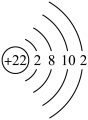 |
D.氧原子核外能量最高的电子云的形状: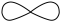 |
您最近一年使用:0次
2023-02-23更新
|
1192次组卷
|
7卷引用:山东省潍坊市2022-2023学年高二上学期期末考试化学试题
山东省潍坊市2022-2023学年高二上学期期末考试化学试题河北省保定市唐县第二中学2022-2023学年高二下学期第一次月考化学试题(已下线)专题11 原子结构 原子结构与元素的性质-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)2024届山东省潍坊市昌乐二中高三模拟预测化学试题(已下线)热点02 化学用语(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
适中(0.65)
名校
4. 下列各组物质中,只用蒸馏水(可用组内物质)无法检验的是
| A.无水硫酸铜、硫酸钠、硫酸钡 | B.过氧化钠、碳酸钠、碳酸氢钠 |
| C.碳酸钠、氢氧化钠、硫酸钾 | D.浓硫酸、NaOH溶液、苯 |
您最近一年使用:0次
2023-10-26更新
|
841次组卷
|
11卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题河北省石家庄部分高中2023-2024学年高三上学期10月期中考试化学试题甘肃省部分校2024届高三上学期10月月考化学试题辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题重庆市百师联盟2024届高三一轮复习联考(二)河北省保定市唐县第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)化学(山东卷02)-2024年高考押题预测卷(已下线)压轴题03?物质的制备、检验、分离与提纯(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 下列关于物质结构和性质的说法正确的是
A.第2周期元素中,第一电离能介于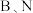 之间的有1种 之间的有1种 |
B.酸性: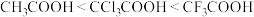 |
C. 与 与 中心原子的杂化方式相同,均为 中心原子的杂化方式相同,均为 形结构 形结构 |
D.乙二胺 的沸点比三甲胺 的沸点比三甲胺 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 |
您最近一年使用:0次
2024-03-21更新
|
621次组卷
|
4卷引用:山东省菏泽市2024届高三一模考试化学试题
山东省菏泽市2024届高三一模考试化学试题山东省滕州市第一中学2023-2024学年高二下学期3月月考化学试题(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
适中(0.65)
名校
6. 结合如下装置(可以重复使用),下列有关说法错误的是


A.可选用装置 制备并收集纯净的 制备并收集纯净的 |
B.制备并收集干燥的 的接口顺序为bcdghj 的接口顺序为bcdghj |
C.可选用 制备 制备 并验证其漂白性 并验证其漂白性 |
| D.G中的倒置漏斗可以用球形干燥管代替 |
您最近一年使用:0次
2023-12-03更新
|
710次组卷
|
4卷引用:山东省德州市第一中学、第二中学2024届高三上学期适应性联考模拟预测化学试题
山东省德州市第一中学、第二中学2024届高三上学期适应性联考模拟预测化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
较易(0.85)
名校
7. 有机物M是合成药物ZJM-289的中间体,其结构简式如图所示。下列有关M的叙述错误的是

| A.存在顺反异构 | B.分子中含有四种含氧官能团 |
| C.分子中的碳原子可能全部共平面 | D.1mol该物质最多与3mol NaOH反应 |
您最近一年使用:0次
2024-03-15更新
|
492次组卷
|
4卷引用:山东省聊城市2023-2024学年高三下学期一模化学试题
山东省聊城市2023-2024学年高三下学期一模化学试题 (已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题山东省聊城市2024年高考模拟试题(一) 化学
单选题
|
适中(0.65)
名校
解题方法
8. 对某溶液中部分离子的定性检测流程如下。相关分析正确的是

| A.步骤①所加试剂可以是浓KOH溶液 |
| B.可以用湿润的蓝色石蕊试纸检验生成的无色气体 |
C.步骤②发生的反应为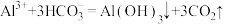 |
D. 遇铁氰化钾会生成蓝色溶液 遇铁氰化钾会生成蓝色溶液 |
您最近一年使用:0次
2024-03-06更新
|
644次组卷
|
18卷引用:四川省成都市2018届高三第二次诊断性检测理综化学试题
四川省成都市2018届高三第二次诊断性检测理综化学试题【全国百强校】广西柳州高级中学2018届高三5月冲刺模拟理科综合化学试题四川省成都外国语学校2017-2018学年高二6月(零诊模拟)月考化学试题山东省泰安第一中学2020届高三上学期期中模拟联合考试化学试题宁夏固原市五原中学补习部2021届高三上学期期中考试化学试题陕西省宝鸡市金台区2021届高三11月检测理综化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题(已下线)专题04 离子反应(缺项配平、离子检验、离子推断、共存)-2021年高考化学必做热点专题(已下线)小题07 描述型实验选择题(侧重物质检验、定量实验) ——备战2021年高考化学经典小题考前必刷(全国通用)黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学2024届陕西省西北工业大学附属中学高三第14次高考适应性训练理科综合试题-高中化学安徽省六安第一中学2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 一种有机物催化剂由原子序数依次递增的前20号元素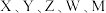 组成,结构式如下图。下列说法正确的是
组成,结构式如下图。下列说法正确的是
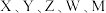 组成,结构式如下图。下列说法正确的是
组成,结构式如下图。下列说法正确的是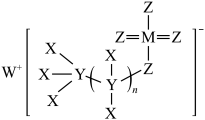
A.简单离子半径: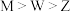 |
B.简单气态氢化物稳定性: |
C. 元素所在周期中,第一电离能大于 元素所在周期中,第一电离能大于 的元素有2种 的元素有2种 |
D.基态 原子电子占据的最高能层有9个原子轨道 原子电子占据的最高能层有9个原子轨道 |
【知识点】 微粒半径大小的比较方法解读 能层与能级 电离能变化规律解读
您最近一年使用:0次
2024-03-15更新
|
1097次组卷
|
6卷引用:山东省潍坊市2023-2024学年高三下学期一模化学试题
山东省潍坊市2023-2024学年高三下学期一模化学试题(已下线)第一章 原子结构与性质(B卷) 四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题山东省枣庄市第十六中学等校2023-2024学年高三下学期5月(一模)考试化学试题
单选题
|
较难(0.4)
解题方法
10. 已知制备 丁内酯的反应
丁内酯的反应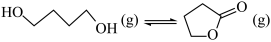
 ,一种机理如图所示(“*”表示此微粒吸附在催化剂表面)。下列说法错误的是
,一种机理如图所示(“*”表示此微粒吸附在催化剂表面)。下列说法错误的是

A.反应物的名称为1,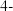 二丁醇 二丁醇 |
B.步骤(a)中 和氧原子间形成共价键 和氧原子间形成共价键 |
C. 在上述合成 在上述合成 丁内酯过程中起催化作用 丁内酯过程中起催化作用 |
D.生成 丁内酯的反应为消去反应 丁内酯的反应为消去反应 |
您最近一年使用:0次
2024-03-21更新
|
627次组卷
|
4卷引用:山东省菏泽市2024届高三一模考试化学试题
单选题
|
适中(0.65)
名校
解题方法
11. 溴代叔丁烷与乙醇的反应进程中的能量变化如图所示。下列说法正确的是
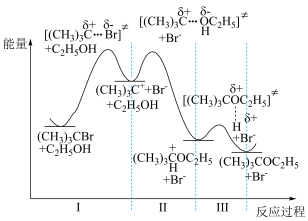
| A.溴代叔丁烷与乙醇的反应为吸热 |
| B.溴代叔丁烷和乙醇的总反应速率由反应Ⅲ决定 |
| C.氯代叔丁烷和乙醇中发生相似的反应,则反应I的活化能将增大 |
D.由该反应原理可推知,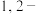 二溴乙烷和乙二醇反应可制得环丁烷 二溴乙烷和乙二醇反应可制得环丁烷 |
您最近一年使用:0次
2024-04-08更新
|
686次组卷
|
5卷引用:湖南省益阳市2024届高三4月联考暨三模考试化学统考试题
湖南省益阳市2024届高三4月联考暨三模考试化学统考试题(已下线)题型8 反应热 电化学的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(山东卷01)-2024年高考押题预测卷湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
单选题
|
适中(0.65)
名校
解题方法
12. 一种原位电化学沉淀技术制备纳米碳酸钙的方法是:向Ca(OH)2过饱和溶液中通入CO2,实验室模拟该方法制备纳米碳酸钙的装置如图所示。下列说法错误的是
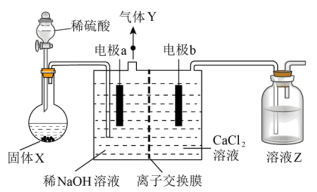
| A.电流方向为电极a→外电路→电极b→电解质溶液→电极a |
| B.X、Y、Z对应的物质依次是块状大理石、H2、NaOH |
| C.离子交换膜为阳离子交换膜 |
| D.理论上外电路每通过2mol电子,则内电路有1mol离子通过交换膜 |
【知识点】 电解原理的应用 电解原理的理解及判断解读
您最近一年使用:0次
2024-01-02更新
|
566次组卷
|
5卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
13. 下列说法正确的是
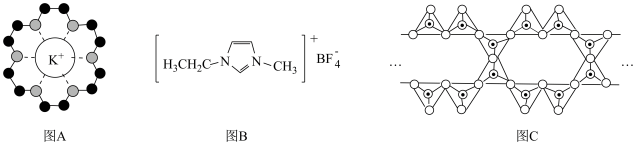
A.图A中,18-冠-6中 原子(灰球)电负性大,带负电荷,通过离子键与 原子(灰球)电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
B.图B物质相较 摩尔质量更大,具更高的熔、沸点 摩尔质量更大,具更高的熔、沸点 |
C.图B中, 该物质含有 该物质含有 键 键 |
D.图C中,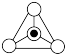 表示硅氧四面体,则该硅酸盐结构的通式为 表示硅氧四面体,则该硅酸盐结构的通式为 |
您最近一年使用:0次
2024-03-01更新
|
854次组卷
|
4卷引用:山东省实验中学2023-2024学年高三(一模)调研考试化学试题
山东省实验中学2023-2024学年高三(一模)调研考试化学试题(已下线)化学(山东卷01)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题山东省枣庄市第三中学2023-2024学年高二下学期期中考试化学试题
多选题
|
适中(0.65)
解题方法
14. 苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用如下反应来制备: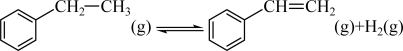 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
| 10min | 20min | 30min | 40min | 50min | |
| 甲 | 20.5% | 39.0% | 54.5% | 60.0% | 60.0% |
| 乙 | 23.5% | 44.5% | 61.0% | 66.8% | x |
| 丙 | 25.0% | 45.5% | 63.8% | 74.0% | 80.0% |
A.20min内,乙苯的平均反应速率 从大到小的顺序是丙>乙>甲 从大到小的顺序是丙>乙>甲 |
| B.若其他条件不变,把容器甲改为恒容容器,则平衡转化率变小 |
C.T1℃时,该反应的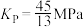 |
| D.50min时,容器丙中的反应已达到平衡状态 |
您最近一年使用:0次
2024-03-27更新
|
508次组卷
|
3卷引用:山东省济南市2023-2024学年高三下学期3月模拟(一模)考试化学试题
三、单选题 添加题型下试题
单选题
|
较难(0.4)
15.  为二元弱酸,常温下向
为二元弱酸,常温下向 溶液滴加
溶液滴加 固体(忽略溶液体积变化),溶液中
固体(忽略溶液体积变化),溶液中 、
、 的百分含量
的百分含量 与
与 的关系如图所示,已知
的关系如图所示,已知 ;如:
;如: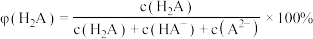 。下列说法不正确的是
。下列说法不正确的是
 为二元弱酸,常温下向
为二元弱酸,常温下向 溶液滴加
溶液滴加 固体(忽略溶液体积变化),溶液中
固体(忽略溶液体积变化),溶液中 、
、 的百分含量
的百分含量 与
与 的关系如图所示,已知
的关系如图所示,已知 ;如:
;如: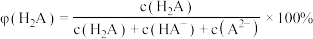 。下列说法不正确的是
。下列说法不正确的是
A.曲线 是 是 的百分含量 的百分含量 |
B. 的 的 的数量级为 的数量级为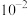 |
C.M点对应溶液中, |
D.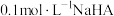 溶液中 溶液中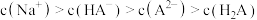 |
您最近一年使用:0次
2023-12-03更新
|
664次组卷
|
4卷引用:山东省德州市第一中学、第二中学2024届高三上学期适应性联考模拟预测化学试题
四、解答题 添加题型下试题
16. 硼族元素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)基态 原子价电子排布式为
原子价电子排布式为_______ 。
(2)常温下, 与硼单质反应生成
与硼单质反应生成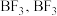 为缺电子结构,通入水中产生三种酸分别为
为缺电子结构,通入水中产生三种酸分别为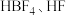 和
和_______ (填化学式)。 和
和 中
中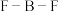 的键角大小顺序是
的键角大小顺序是_______ ,实验测得 中3个
中3个 键长远比
键长远比 和
和 的半径之和小,原因是
的半径之和小,原因是_______ 。
(3)一定条件下,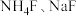 和
和 反应生成
反应生成 和化合物X。X晶胞及晶胞中某一原子的俯视投影如图所示,晶胞参数为
和化合物X。X晶胞及晶胞中某一原子的俯视投影如图所示,晶胞参数为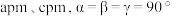 。
。_______ ,X晶体内含有的作用力有_______ (填字母)。
a.配位键 b.离子键 c.氢键 d.金属键 。化合物X的密度为
。化合物X的密度为_______  (用含
(用含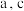 的代数式表示)。
的代数式表示)。
(1)基态
 原子价电子排布式为
原子价电子排布式为(2)常温下,
 与硼单质反应生成
与硼单质反应生成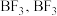 为缺电子结构,通入水中产生三种酸分别为
为缺电子结构,通入水中产生三种酸分别为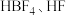 和
和 和
和 中
中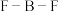 的键角大小顺序是
的键角大小顺序是 中3个
中3个 键长远比
键长远比 和
和 的半径之和小,原因是
的半径之和小,原因是(3)一定条件下,
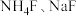 和
和 反应生成
反应生成 和化合物X。X晶胞及晶胞中某一原子的俯视投影如图所示,晶胞参数为
和化合物X。X晶胞及晶胞中某一原子的俯视投影如图所示,晶胞参数为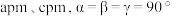 。
。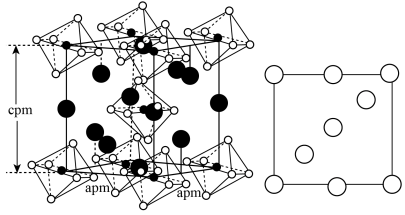
a.配位键 b.离子键 c.氢键 d.金属键
用原子分数坐标来描述晶胞中所有 原子的位置,需要
原子的位置,需要 原子。
原子。
 。化合物X的密度为
。化合物X的密度为 (用含
(用含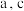 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-03-15更新
|
581次组卷
|
3卷引用:山东省潍坊市2023-2024学年高三下学期一模化学试题
解答题-工业流程题
|
较难(0.4)
名校
解题方法
17. 一种以钌矿石[主要含Ru(CO3)2还含少量的Al2O3、FeO、MgO、SiO2和CaO等]为原料制备钌(Ru)的流程如图,回答下列问题: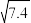 ≈2.7,
≈2.7, ≈3.9
≈3.9
②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为______ ,滤液1中溶质为______ 。
(2)“沉铁”的离子方程式为______ 。
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为______ 。
(4)“灼烧”时Ar的作用是______ 。
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为______ ;从安全角度分析,方案2优于方案1,其理由是______ 。
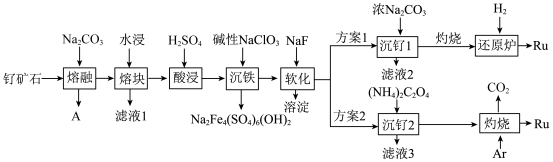
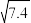 ≈2.7,
≈2.7, ≈3.9
≈3.9②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为
(2)“沉铁”的离子方程式为
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为
(4)“灼烧”时Ar的作用是
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为
您最近一年使用:0次
2024-03-21更新
|
444次组卷
|
3卷引用:山东省济宁市2024届高三下学期一模考试化学试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
18. 二硫化钨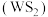 是一种乌精细化工产品,主要用作石油催化剂和润滑剂。实验室利用反应
是一种乌精细化工产品,主要用作石油催化剂和润滑剂。实验室利用反应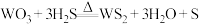 制备
制备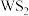 的装置如图所示(夹持装置略)。已知:
的装置如图所示(夹持装置略)。已知: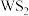 常温下为黑灰色固体,熔点1250℃;S的沸点445℃;
常温下为黑灰色固体,熔点1250℃;S的沸点445℃; 的沸点77℃。回答下列问题:
的沸点77℃。回答下列问题: ,打开
,打开 。操作(ⅱ)为
。操作(ⅱ)为_______ ;A中发生反应的离子方程式为_______ 。
(2)C为U型水柱压力计,其作用是_______ 。D中盛装的药品是_______ (填化学式)。反应结束后应继续通一段时间氩气,主要目的是_______ ,从产物中分离得到S的操作是_______ 。
(3)粗产品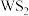 中残留的游离硫可用
中残留的游离硫可用 浸取-碘量法测定。称取
浸取-碘量法测定。称取 产品于锥形瓶中,用足量
产品于锥形瓶中,用足量 浸取,浸取后用快速滤纸过滤并用
浸取,浸取后用快速滤纸过滤并用 分次洗涤锥形瓶及滤纸上的残渣,将滤液和洗涤液都收集于烧杯中。烘烤烧杯浓缩溶液,将浓缩液和烧杯洗涤液转入石英舟于红外灯下烘干。将石英舟置于管式炉中通
分次洗涤锥形瓶及滤纸上的残渣,将滤液和洗涤液都收集于烧杯中。烘烤烧杯浓缩溶液,将浓缩液和烧杯洗涤液转入石英舟于红外灯下烘干。将石英舟置于管式炉中通 燃烧,生成的
燃烧,生成的 被
被 的碘标准液恰好完全吸收。产品中游离硫的质量分数
的碘标准液恰好完全吸收。产品中游离硫的质量分数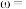
_______ ,下列情况会导致 测量值偏小的是
测量值偏小的是_______ (填标号)。
A.用快速滤纸过滤时消耗时间过长
B.过滤时没有洗涤锥形瓶
C.管式炉中通 燃烧时
燃烧时 过量
过量
D.量取碘标准吸收液结束时,发现滴定管尖嘴内有气泡
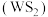 是一种乌精细化工产品,主要用作石油催化剂和润滑剂。实验室利用反应
是一种乌精细化工产品,主要用作石油催化剂和润滑剂。实验室利用反应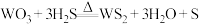 制备
制备 的装置如图所示(夹持装置略)。已知:
的装置如图所示(夹持装置略)。已知: 常温下为黑灰色固体,熔点1250℃;S的沸点445℃;
常温下为黑灰色固体,熔点1250℃;S的沸点445℃; 的沸点77℃。回答下列问题:
的沸点77℃。回答下列问题: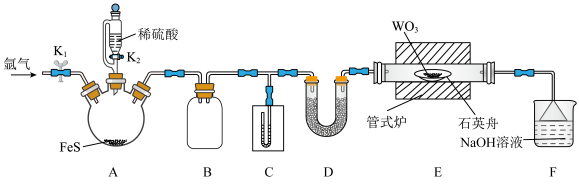
 ,打开
,打开 。操作(ⅱ)为
。操作(ⅱ)为(2)C为U型水柱压力计,其作用是
(3)粗产品
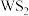 中残留的游离硫可用
中残留的游离硫可用 浸取-碘量法测定。称取
浸取-碘量法测定。称取 产品于锥形瓶中,用足量
产品于锥形瓶中,用足量 浸取,浸取后用快速滤纸过滤并用
浸取,浸取后用快速滤纸过滤并用 分次洗涤锥形瓶及滤纸上的残渣,将滤液和洗涤液都收集于烧杯中。烘烤烧杯浓缩溶液,将浓缩液和烧杯洗涤液转入石英舟于红外灯下烘干。将石英舟置于管式炉中通
分次洗涤锥形瓶及滤纸上的残渣,将滤液和洗涤液都收集于烧杯中。烘烤烧杯浓缩溶液,将浓缩液和烧杯洗涤液转入石英舟于红外灯下烘干。将石英舟置于管式炉中通 燃烧,生成的
燃烧,生成的 被
被 的碘标准液恰好完全吸收。产品中游离硫的质量分数
的碘标准液恰好完全吸收。产品中游离硫的质量分数
 测量值偏小的是
测量值偏小的是A.用快速滤纸过滤时消耗时间过长
B.过滤时没有洗涤锥形瓶
C.管式炉中通
 燃烧时
燃烧时 过量
过量D.量取碘标准吸收液结束时,发现滴定管尖嘴内有气泡
您最近一年使用:0次
2024-03-15更新
|
497次组卷
|
4卷引用:山东省潍坊市2023-2024学年高三下学期一模化学试题
解答题-有机推断题
|
适中(0.65)
19. 帕罗维德(Paxlovid)是一种有效的新冠病毒抑制剂,可以在病毒感染早期有效干预抑制病毒复制。下图是合成帕罗韦德的重要中间体之一(I)的合成路线。
(1)A→B的原子利用率100%,A的名称是___________ ,D的名称是___________ 。
(2)C→D的反应类型___________ ,E中官能团的名称是___________ 。
(3)F的分子式___________ 。
(4)写出G→H转化第一步反应的离子方程式___________ 。
(5)芳香化合物N为I的同分异构体,写出满足下列条件N的结构简式___________ 。
①能与FeCl3溶液发生显色反应;
②1molN最多消耗2molNaOH;
③磁共振氢谱中有4组峰,其峰面积之比为3:2:2:1;
(6)结合以上流程,设计以乙炔和乙醇为原料制备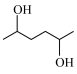 的合成路线
的合成路线___________ (无机试剂任选)。
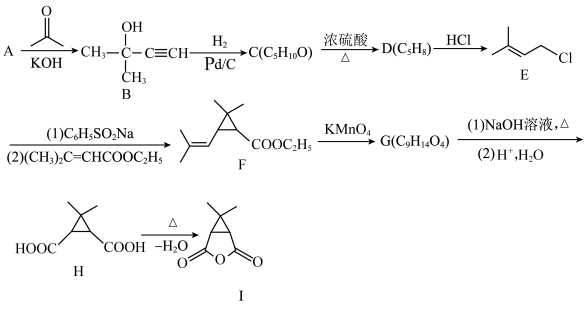
(1)A→B的原子利用率100%,A的名称是
(2)C→D的反应类型
(3)F的分子式
(4)写出G→H转化第一步反应的离子方程式
(5)芳香化合物N为I的同分异构体,写出满足下列条件N的结构简式
①能与FeCl3溶液发生显色反应;
②1molN最多消耗2molNaOH;
③磁共振氢谱中有4组峰,其峰面积之比为3:2:2:1;
(6)结合以上流程,设计以乙炔和乙醇为原料制备
 的合成路线
的合成路线
您最近一年使用:0次
2024-01-15更新
|
457次组卷
|
3卷引用:2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题
解答题-原理综合题
|
适中(0.65)
20. 党的二十大报告中强调“实现碳达峰、碳中和是一场广泛而深刻的经济社会系统性变革”。利用CO2合成淀粉的研究成果已经被我国科学家发表在《Nature》杂志上,其涉及的关键反应如下:
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ•mol-1
Ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3=
(1)反应Ⅲ的△H3=_______ ,该反应自发进行的条件是______ (填“高温自发”、“低温自发”或“任何温度下都自发”)。
(2)在该反应体系中,下列有关说法错误的是______ 。
(3)反应Ⅱ的反应速率v=v正- v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应速率常数,影响速率常数k的因素有温度和催化剂等。该反应的平衡常数K= ,升高温度时,k正-k逆是
,升高温度时,k正-k逆是_______ (填“增大”、“减小”或“不变”)。
(4)在催化剂作用下,向某恒容密闭容器中通入1molCO2和3molH2,只发生I、Ⅱ两个反应。测得不同温度下CO2的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。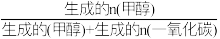 ×100%
×100%
①根据图中数据,温度选择_______ K达到平衡时,反应体系内甲醇的产量最高。随着温度的升高,CO2的平衡转化率增加,但甲醇的选择率降低,请分析其原因:________ 。
②513K时,平衡体系的压强为p0MPa,体系中n(H2O)=_______ mol,反应Ⅱ的Kp=_______ (列出计算式即可)。
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ•mol-1
Ⅲ.CO(g)+2H2(g)=CH3OH(g) △H3=
(1)反应Ⅲ的△H3=
(2)在该反应体系中,下列有关说法错误的是
| A.增大H2的浓度有利于提高CO2的转化率 |
| B.升高温度,反应Ⅱ的速率加快,反应I的速率减慢 |
| C.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
| D.达到平衡后,若压缩体积,反应I平衡正向移动,反应Ⅱ平衡不移动 |
(3)反应Ⅱ的反应速率v=v正- v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应速率常数,影响速率常数k的因素有温度和催化剂等。该反应的平衡常数K=
 ,升高温度时,k正-k逆是
,升高温度时,k正-k逆是(4)在催化剂作用下,向某恒容密闭容器中通入1molCO2和3molH2,只发生I、Ⅱ两个反应。测得不同温度下CO2的平衡转化率和甲醇的选择率随温度的变化趋势如图所示。
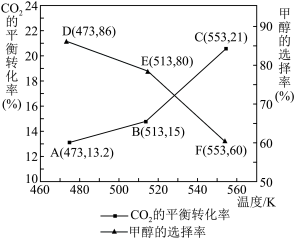
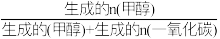 ×100%
×100%①根据图中数据,温度选择
②513K时,平衡体系的压强为p0MPa,体系中n(H2O)=
您最近一年使用:0次
2024-03-20更新
|
704次组卷
|
5卷引用:内蒙古赤峰市2024届高三一模理科综合-化学试题
内蒙古赤峰市2024届高三一模理科综合-化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(山东卷03)-2024年高考押题预测卷湖南省衡阳县第四中学2023-2024学年高三下学期4月月考化学试题2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、化学与STSE、常见无机物及其应用、化学反应原理、化学实验基础、物质结构与性质、有机化学基础
试卷题型(共 20题)
题型
数量
单选题
13
多选题
2
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 胶体的定义及分类 硅酸盐工业的一般特点总结及判断 | |
| 2 | 0.94 | 硫与金属单质的反应 酸碱中和滴定实验相关仪器 实验安全 | |
| 3 | 0.85 | 原子结构示意图、离子结构示意图 核外电子运动 电子排布式 轨道表示式 | |
| 4 | 0.65 | 过氧化钠与水的反应 碳酸氢钠的俗称、物理性质及用途 苯的物理性质及其在实验中的体现 物质检验和鉴别的基本方法选择及应用 | |
| 5 | 0.65 | 电离能变化规律 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 氢键对物质性质的影响 | |
| 6 | 0.65 | 氯气的实验室制法 氨气的实验室制法 二氧化硫的化学性质 常用仪器及使用 | |
| 7 | 0.85 | 有机分子中原子共面的判断 羧酸的酸性 含酯基有机物水解消耗NaOH的量的计算 | |
| 8 | 0.65 | 铵根离子的检验 铝三角转化 物质分离、提纯综合应用 离子的检验 | |
| 9 | 0.65 | 微粒半径大小的比较方法 能层与能级 电离能变化规律 | |
| 10 | 0.4 | 醇的系统命名法 消去反应 共价键的形成及主要类型 | |
| 11 | 0.65 | 吸热反应和放热反应 活化能及其对反应速率的影响 键能、键长、键角及应用 | |
| 12 | 0.65 | 电解原理的应用 电解原理的理解及判断 | |
| 15 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐的水解常数 弱电解质的电离平衡常数 | |
| 二、多选题 | |||
| 13 | 0.65 | 简单配合物的成键 根据晶胞结构确定晶体化学式 晶格能 | |
| 14 | 0.65 | 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 化学反应速率与化学平衡的综合应用 | |
| 三、解答题 | |||
| 16 | 0.65 | 电子排布式 简单配合物的成键 根据晶胞结构确定晶体化学式 晶胞的有关计算 | 结构与性质 |
| 17 | 0.4 | 氧化还原反应方程式的书写与配平 溶度积常数相关计算 物质分离、提纯综合应用 物质制备的探究 | 工业流程题 |
| 18 | 0.65 | 硫化氢 常见无机物的制备 探究物质组成或测量物质的含量 化学实验方案的设计与评价 | 实验探究题 |
| 19 | 0.65 | 根据要求书写同分异构体 含酯基有机物水解消耗NaOH的量的计算 根据题给物质选择合适合成路线 有机合成综合考查 | 有机推断题 |
| 20 | 0.65 | 盖斯定律与热化学方程式 化学平衡的移动及其影响因素 化学平衡常数的有关计算 | 原理综合题 |



