名校
解题方法
1 . 酞菁和酞菁钴可制得光动力学中的光敏剂,分子结构如图,其中酞菁分子中所有原子共平面,下列说法正确的是
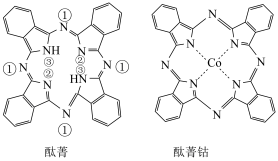
| A.酞菁钴中钴的化合价为+4 |
| B.直径为1.5×10–9 m的酞菁钴分子能透过半透膜 |
| C.酞菁钴中元素的电负性由大到小的顺序为N>C>H>Co |
| D.标注①②的N原子的杂化方式是sp2,③的N原子的杂化方式是sp3 |
您最近半年使用:0次
2024-03-13更新
|
470次组卷
|
2卷引用:山东省烟台市2023-2024学年高三上学期期末考试化学试题
2 . 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。回答下列问题。
(1)Fe 位于元素周期表中第_______ 周期第_______ 族,其价层电子排布式为_______ 。
(2)用“>”“<”或“=”填空:离子半径:Li+_______ H-;第一电离能:Li_______ Be;电负性:O_______ P。
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.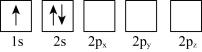 B.
B.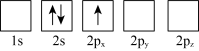
C. D.
D.
(4)基态 P 中未成对电子数为_______ ,其原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
(1)Fe 位于元素周期表中第
(2)用“>”“<”或“=”填空:离子半径:Li+
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(4)基态 P 中未成对电子数为
您最近半年使用:0次
名校
解题方法
3 . 下列说法正确的是
A.酸性: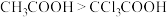 |
| B.HF酸电离平衡正向移动时,其电离程度一定增大 |
C.甲基是推电子基团,所以结合氢离子的能力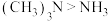 |
D.分子: ,键角: ,键角: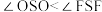 |
您最近半年使用:0次
4 . 原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式: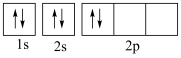
⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示 的形成过程:
的形成过程: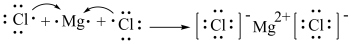
⑧基态钒原子的结构示意图为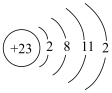
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__________ 、__________ 。
A.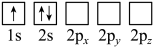 B.
B.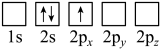
C.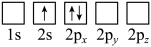 D.
D.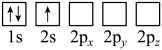
(3)研究发现,正离子的颜色与未成对电子数有关,例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是__________ (从微粒结构的角度进行描述)。
(4)钠在火焰上灼烧产生的黄光是一种原子__________ 光谱(选填“发射”或“吸收”)。
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为__________ ,按照电子排布式,镍元素在周期表中位于__________ 区。
②“玉兔二号”月球车通过砷化镓 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为__________ 形。砷的电负性比镓__________ (填“大”或“小”)。
(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
①预测x值的区间:______ ~______ 。
②表中五种元素的第一电离能由大到小的顺序是__________ (写元素符号)。
(1)下列说法中正确的个数是__________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式:

⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示
 的形成过程:
的形成过程:
⑧基态钒原子的结构示意图为

| A.2 | B.3 | C.4 | D.5 |
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(3)研究发现,正离子的颜色与未成对电子数有关,例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是(4)钠在火焰上灼烧产生的黄光是一种原子
(5)第四周期的元素形成的化合物在生产生活中有着重要的用途。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
②“玉兔二号”月球车通过砷化镓
 太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为(6)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
元素编号 | a | b | c | d | e |
电负性 | 3.0 | 2.5 | x | 1.5 | 0.9 |
主要化合价 |
|
|
|
|
|
②表中五种元素的第一电离能由大到小的顺序是
您最近半年使用:0次
2024-03-08更新
|
271次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高二上学期1月期末考试化学试题
5 . 某种新型储氢材料的晶胞如图,八面体中心M为铁元素金属离子,顶点均为 配体;四面体中心为硼原子,顶点均为氢原子,下列说法正确的是
配体;四面体中心为硼原子,顶点均为氢原子,下列说法正确的是
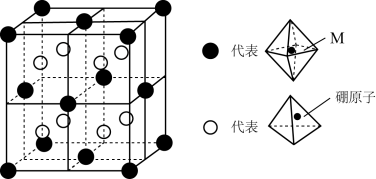
 配体;四面体中心为硼原子,顶点均为氢原子,下列说法正确的是
配体;四面体中心为硼原子,顶点均为氢原子,下列说法正确的是
A.黑球微粒的化学式为 | B.白球微粒中存在配位键,硼原子提供空轨道 |
C.晶体中 分子间可能存在氢键作用 分子间可能存在氢键作用 | D.晶体中所含元素的电负性大小顺序为N>B>H>Fe |
您最近半年使用:0次
6 . 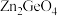 是一种新型光催化剂.下列说法错误的是
是一种新型光催化剂.下列说法错误的是
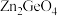 是一种新型光催化剂.下列说法错误的是
是一种新型光催化剂.下列说法错误的是| A.Zn处于元素周期表中的ds区 |
B.基态Ge的价电子排布式为 |
| C.基态O原子的纺锤形轨道中电子具有的能量都相同 |
| D.三种元素电负性由大到小的顺序是O>Ge>Zn |
您最近半年使用:0次
解题方法
7 . X、Y、Z、W的原子序数依次增大的前四周期元素,X的基态原子核外电子位于四个原子轨道上,Y与X位于同一周期, 与
与 具有相同的电子构型,W为过渡元素,其基态原子最外层电子数与基态Cu原子最外层电子数相同。下列说法正确的是
具有相同的电子构型,W为过渡元素,其基态原子最外层电子数与基态Cu原子最外层电子数相同。下列说法正确的是
 与
与 具有相同的电子构型,W为过渡元素,其基态原子最外层电子数与基态Cu原子最外层电子数相同。下列说法正确的是
具有相同的电子构型,W为过渡元素,其基态原子最外层电子数与基态Cu原子最外层电子数相同。下列说法正确的是A. 分子是一种弱电解质 分子是一种弱电解质 |
| B.电负性:Y>X>Z>W |
C.Y、W形成的 的结构式可表示为 的结构式可表示为 |
| D.工业上用相同的方法制备Z单质和W单质 |
您最近半年使用:0次
8 . 氮氧化物会导致光化学烟雾和酸雨,在 的催化作用下,
的催化作用下, 可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
 的催化作用下,
的催化作用下, 可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
可将NO还原为无污染的气体,反应历程如图,下列说法正确的是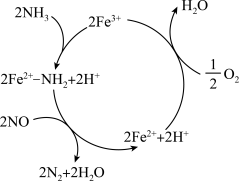
A.基态 的价层电子排布式为 的价层电子排布式为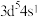 |
| B.电负性:N>O>H>Fe |
| C.该过程中存在极性键和非极性键的断裂和形成 |
D.图中的总反应可表示为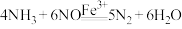 |
您最近半年使用:0次
2024-02-25更新
|
260次组卷
|
5卷引用:山东省青岛市莱西市2023-2024学年高二上学期1月期末考试化学试题
9 . 结构决定性质,下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 键能:F-F键<Cl-Cl键 | 电负性 |
| B | 稳定性:H2O>H2S | 半径:O<S |
| C | 酸性:HClO3<HClO4 | 羟基极性 |
| D | 沸点:正戊烷>新戊烷 | 分子间作用力 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . 元素A、D、E、W、X、Y、Z基态原子,原子序数依次增大且分占前四周期,D的各能级电子数相等;E的核外电子有3种空间运动状态。W的价电子排布式为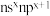 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
(1)Z元素在周期表中的位置为:___________ ;位于周期表___________ 区。
(2)D、E、W元素第一电离能由大到小顺序为:___________ ;电负性由大到小顺序为:___________ 。
(3)比较键角:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为___________ 。
(5)某物质晶胞结构如图所示。
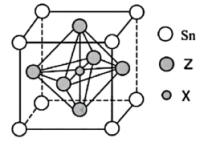
①该物质的化学式可以表示为___________ 。
②该晶胞中距离最近的 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
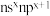 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:(1)Z元素在周期表中的位置为:
(2)D、E、W元素第一电离能由大到小顺序为:
(3)比较键角:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为
(5)某物质晶胞结构如图所示。

①该物质的化学式可以表示为
②该晶胞中距离最近的
 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近半年使用:0次

 ,
,
 ,
,
 ,
,




