1 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)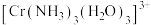 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
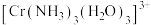 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
2024-02-01更新
|
269次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
2 . 铬元素是哺乳类代谢过程中必须的微量元素,目前六氟代乙酰丙酮铬(Ⅲ)螯合物(其结构如图)的检出极限已达到 。回答下列问题:
。回答下列问题:
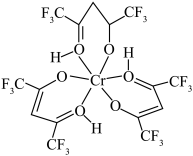
(1)基态铬原子的价电子排布式为___________ ,H、C、O、F的电负性由大到小的顺序为___________ 。
(2)与 具有相同未成对电子数的同周期基态原子的元素有
具有相同未成对电子数的同周期基态原子的元素有___________ 种,其中原子序数最大的元素在周期表中的位置是___________ 。
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有___________ 。
a.极性共价键 b.非极性共价键 c.离子键 d.配位键
(4)六氟代乙酰丙酮(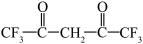 )中
)中 键有
键有___________ 个。
(5)分子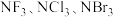 中键角由小到大的顺序是
中键角由小到大的顺序是___________ ,其原因是___________ 。
 。回答下列问题:
。回答下列问题:
(1)基态铬原子的价电子排布式为
(2)与
 具有相同未成对电子数的同周期基态原子的元素有
具有相同未成对电子数的同周期基态原子的元素有(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有
a.极性共价键 b.非极性共价键 c.离子键 d.配位键
(4)六氟代乙酰丙酮(
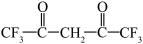 )中
)中 键有
键有(5)分子
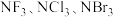 中键角由小到大的顺序是
中键角由小到大的顺序是
您最近一年使用:0次
解题方法
3 . 亚铁氰化钾( )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(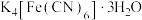 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(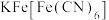 )。回答下列问题。
)。回答下列问题。
(1)O元素位于_______ 区,基态O原子核外电子的空间运动状态有_______ 种。
(2)Fe在元素周期表中的位置_______ ,基态Fe原子的价电子轨道表示式为_______ 。
(3)黄血盐(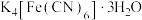 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是_______ ,该原子能量最高的电子所在能级符号为_______ 。
(4)亚铁氰化钾( )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为_______ 。
(5)普鲁士蓝(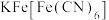 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是_______ ,其原因是_______ 。
 )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(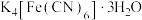 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(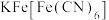 )。回答下列问题。
)。回答下列问题。(1)O元素位于
(2)Fe在元素周期表中的位置
(3)黄血盐(
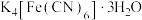 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是(4)亚铁氰化钾(
 )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为(5)普鲁士蓝(
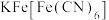 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是
您最近一年使用:0次
4 . 某多孔储氢材料结构如图,M、W、X、Y、Z均为短周期元素,原子序数依次增大,Z比Y原子序数大9,下列说法正确的是
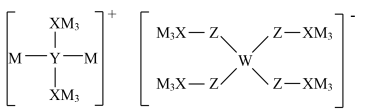
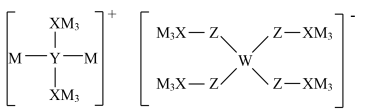
| A.电负性:W>X |
| B.最高价氧化物对应水化物的酸性:Y>X |
| C.氢化物的沸点:X<Y |
| D.M、Y、Z不能形成离子化合物 |
您最近一年使用:0次
名校
解题方法
5 . 铁系元素是指铁、钴和镍3种元素,位于元素周期表中第VIII族,均为金属元素,在工业生产中有重要的作用。
(1)基态铁元素的原子核外电子占据的轨道数目共_______ 个,基态钴元素的价电子排布式为_______ 。
(2)铁系元素常常能和许多配位体形成配合物。
①若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA( )是
)是_______ 齿配位体,与铁离子形成配合物时的配位原子为_______ ,EDTA中所含元素的电负性由大到小的顺序为:_______ 。
②铁系元素形成的很多配合物有特殊的颜色,可用于鉴定铁系元素。用 检验
检验 时,若有
时,若有 存在会产生干扰,可加入掩蔽剂NaF,
存在会产生干扰,可加入掩蔽剂NaF, 与
与 结合形成更稳定无色配离子
结合形成更稳定无色配离子 ,该配离子的空间构型为:
,该配离子的空间构型为:_______ 。
(3)铁与镁组成的其中一种储氢合金的晶胞结构如图所示,其中铁原子和镁原子最近的距离是为a nm, 代表阿伏加德罗常数。
代表阿伏加德罗常数。

图中a处原子的坐标参数为_______ ,合金的密度为_______  。(列计算式)
。(列计算式)
(1)基态铁元素的原子核外电子占据的轨道数目共
(2)铁系元素常常能和许多配位体形成配合物。
①若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是②铁系元素形成的很多配合物有特殊的颜色,可用于鉴定铁系元素。用
 检验
检验 时,若有
时,若有 存在会产生干扰,可加入掩蔽剂NaF,
存在会产生干扰,可加入掩蔽剂NaF, 与
与 结合形成更稳定无色配离子
结合形成更稳定无色配离子 ,该配离子的空间构型为:
,该配离子的空间构型为:(3)铁与镁组成的其中一种储氢合金的晶胞结构如图所示,其中铁原子和镁原子最近的距离是为a nm,
 代表阿伏加德罗常数。
代表阿伏加德罗常数。
图中a处原子的坐标参数为
 。(列计算式)
。(列计算式)
您最近一年使用:0次
2022-07-13更新
|
198次组卷
|
2卷引用:山东省德州市2021-2022学年高二下学期期末考试化学试题
名校
6 . X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z均可与X形成含10个电子的分子,且第一电离能Y>Z。W原子电离能:I1=500、I2=4600、I3=6900、I4=9500、I5…,下列说法错误的是
| A.Y、Z还均可与X形成含18个电子的分子 |
| B.这四种元素位于三个不同周期 |
| C.简单离子半径:Y>Z>W |
| D.电负性:Y>Z>X |
您最近一年使用:0次
2022-02-20更新
|
432次组卷
|
3卷引用:山东省德州市2021-2022学年高二上学期期末考试化学试题
7 . 下列描述不正确的是
| A.铁制品上使用铜配件,在接触处铁更易生锈 |
| B.以KOH溶液为离子导体的CH4-O2燃料电池,工作一段时间后溶液的pH减小 |
| C.先将足量二氧化碳通入饱和食盐水,再通入氨气降温可析出碳酸氢钠固体 |
| D.熔融状态下AlCl3不导电而AlF3导电,可以说明电负性F>Cl |
您最近一年使用:0次
名校
解题方法
8 . 元素H、C、N可组成多种杂环化合物,例如 (吡啶)、
(吡啶)、 (吡咯),下列说法错误的是
(吡咯),下列说法错误的是
 (吡啶)、
(吡啶)、 (吡咯),下列说法错误的是
(吡咯),下列说法错误的是A.电负性: | B. 中, 中, 为 为 杂化 杂化 |
C. 、 、 都难溶于水 都难溶于水 | D. 、 、 都含有II键 都含有II键 |
您最近一年使用:0次
2022-01-19更新
|
314次组卷
|
3卷引用:山东省德州市2021-2022学年高三上学期期末考试化学试题
山东省德州市2021-2022学年高三上学期期末考试化学试题(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)甘肃省高台县第一中学2021-2022学年高二下学期3月月考化学试题
解题方法
9 . 己二酸在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,其制备反应为:3 +8HNO3
+8HNO3 3
3 +8NO↑+7H2O。
+8NO↑+7H2O。
(1)有机反应物的名称为:
(2)己二酸中所含化学键的类型为
a.σ键b.π键c.极性共价键d.非极性共价键e.离子键f.氢键
(3)该反应方程式中所涉及元素的电负性从大到小的顺序为
(4)反应物硝酸可脱水生成N2O5,固态N2O5由 和一种一价阳离子构成,则其中阴、阳离子的空间构型依次为
和一种一价阳离子构成,则其中阴、阳离子的空间构型依次为
您最近一年使用:0次
名校
解题方法
10 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )


| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素第一电离能:Z>W>Y |
| C.L的沸点一定比X、Y组成的化合物沸点高 |
| D.由X、Y、Z、W构成的化合物中只能含有共价键 |
您最近一年使用:0次
2020-06-24更新
|
552次组卷
|
6卷引用:山东省德州市宁津县第一中学2019-2020学年高二下学期期末考试化学试题



