1 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是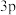 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
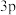 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是A.电负性: ,原子半径: ,原子半径: | B.同周期中,元素Z的第一电离能最大 |
C.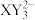 离子中存在 离子中存在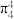 的离域π键 的离域π键 | D.在一定条件下,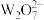 和 和 均具有强氧化性 均具有强氧化性 |
您最近半年使用:0次
解题方法
2 . 某化合物的结构如图所示,其中X、Y、Z、Q为原子序数依次增大的四种短周期元素,X是元素周期表中原子半径最小的元素,Q的最外层电子数是其内层电子数的3倍。下列说法错误的是
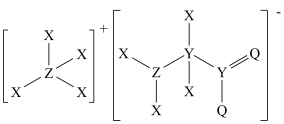

| A.四种元素中原子半径最大的是Y |
| B.Y、Z和Q三种元素的电负性逐渐减弱 |
| C.X和Q形成的化合物中可存在非极性键 |
| D.该化合物中Z、Y、Q均满足8电子稳定结构 |
您最近半年使用:0次
名校
3 . 过渡元素镍(Ni)、铬(Cr)都是重要的合金元素,他们的配合物在科技生活中都有很重要的应用,例如我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:

回答下列问题:
(1)Cr3+价电子核外电子排布式为______ ,分子甲中除铬外其他元素的电负性由大到小依次为______ (填元素符号)。
(2)一定条件下环戊二烯 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为_____ , 中大π键可表示为
中大π键可表示为_____ 。
(3)化合物丙中1、2、3、4处的化学键是配位键的是_______ 。
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是__________ 。
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为_________ 。
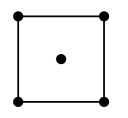
(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是_________ (用字母a、b、c表示),晶胞中镍的分数坐标有____ 种。


回答下列问题:
(1)Cr3+价电子核外电子排布式为
(2)一定条件下环戊二烯
 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为 中大π键可表示为
中大π键可表示为(3)化合物丙中1、2、3、4处的化学键是配位键的是
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为

(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是

您最近半年使用:0次
解题方法
4 . 类比推理是化学中常用的思维方法。下列推理错误的是
A. 能与 能与 反应生成 反应生成 ,则 ,则 也可以与 也可以与 反应生成 反应生成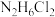 |
B.乙炔( )不存在顺反异构现象,则亚肼( )不存在顺反异构现象,则亚肼(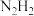 )也不存在顺反异构现象 )也不存在顺反异构现象 |
C.三氟乙酸( )的酸性强于乙酸,则三氟化氮( )的酸性强于乙酸,则三氟化氮( )的碱性强于氨气 )的碱性强于氨气 |
D. 为三角双锥结构,则 为三角双锥结构,则 也是三角双锥结构 也是三角双锥结构 |
您最近半年使用:0次
5 . 下列说法正确的是
A. 、 、 、 、 、 、 互为同素异形体 互为同素异形体 |
| B.硬度:白磷>冰>二氧化硅 |
C.酸性: |
D.键角: |
您最近半年使用:0次
解题方法
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数目的2倍,Y与X能形成一种以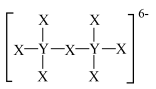 形式存在的阴离子,Z与X的最外层电子数目相同。下列说法错误的是
形式存在的阴离子,Z与X的最外层电子数目相同。下列说法错误的是
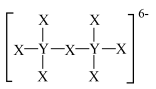 形式存在的阴离子,Z与X的最外层电子数目相同。下列说法错误的是
形式存在的阴离子,Z与X的最外层电子数目相同。下列说法错误的是| A.原子半径:Y>Z>X | B.简单离子的还原性:Z>W>X |
| C.四种元素中,Y的电负性最小 | D.同周期元素中,W的第一电离能最大 |
您最近半年使用:0次
解题方法
7 . 材料是人类文明进步的阶梯,主族非金属元素是组成特殊材料的重要元素。请回答下列问题:
(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是_____ ,第一电离能从大到小的顺序是_____ 。
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是______ (填化学式);已知等电子体具有相同的空间构型,结合价电子对互斥理论可知N2O分子为______ 形。
(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是_____ (填符号);配合物T与[M(NH3)5(H2O)]Cl3组成所含微粒种类和数目相同,中心离子的配位数相同且T中也只有两种配体,若1molT溶于水,加入足量AgNO3溶液只生成2molAgCl,则T的配合物可表示为_____ 。
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为_____ 。

(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO
 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为

您最近半年使用:0次
解题方法
8 . Fe为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)甘氨酸亚铁络合物[ ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。
① 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为___________ 。
②甘氨酸( )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是___________ 。
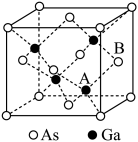
II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]___________ 。
(3)根据元素周期律,元素的电负性Ga___________ (填“大于”或“小于”)As。
(4)杀虫剂Na3AsO4中As原子采取___________ 杂化。
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为___________ (列出计算式,阿伏加德罗常数的值用NA表示) 。
。
(1)甘氨酸亚铁络合物[
 ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。①
 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为②甘氨酸(
 )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]
(3)根据元素周期律,元素的电负性Ga
(4)杀虫剂Na3AsO4中As原子采取
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为
 。
。
您最近半年使用:0次
解题方法
9 . 下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中 与 与 间的作用力大于碘晶体中分子间的作用力 间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比SnH4分子稳定性大 | Sn的原子半径比C的大,Sn与H之间的键能比C与H之间的键能小 |
| C | 酸性:三氟乙酸>三氯乙酸>乙酸 | 电负性:F>Cl>H |
| D | 邻羟基苯甲醛的熔沸点比对羟基苯甲醛的熔沸点高 | 邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . W、X、Y、Z为原子序数依次增大的短周期主族元素,X与Z位于相邻主族,W、X、Z价电子数之和等于Y的价电子数,它们组成的化合物结构如图。
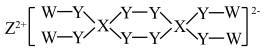
下列说法正确的是
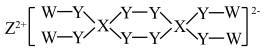
下列说法正确的是
| A.W与Y化合物的化学键有方向性和饱和性 |
| B.X的最高价氧化物的水化物为强酸 |
| C.Y所在周期中电负性比Y大的元素有2种 |
| D.W、Y、Z形成的化合物含有离子键和极性共价键 |
您最近半年使用:0次
2023-05-07更新
|
176次组卷
|
2卷引用:山东省青岛地区2022-2023学年高二下学期期中考试化学试题



