解题方法
1 . 二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______ ,基态 中的核外电子有
中的核外电子有_______ 个空间运动状态。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
① 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是_______ ,B原子的杂化轨道类型是_______ , 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为_______ 。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______ 填元素符号。
(1)基态钛原子的价电子排布式为
 中的核外电子有
中的核外电子有(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①
 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是
| 元素 | M |
| 电离能(kJ/mol) | 738 |
| 1451 | |
| 7733 | |
| 10540 | |
| 13630 |
您最近一年使用:0次
2 . 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,下列叙述中正确的是
 | ||
 | ||
 |
| A.X的第一电离能在同周期中最小 | B.氢化物稳定性: |
C.最高价氧化物水化物酸性: | D.电负性: |
您最近一年使用:0次
解题方法
3 . 三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)是制备铁触媒的主要原料。该配合物在光照下发生分解:2K3[Fe(C2O4)3]·3H2O 3K2C2O4+2FeC2O4+2CO2↑+6H2O。下列说法错误的是
3K2C2O4+2FeC2O4+2CO2↑+6H2O。下列说法错误的是
 3K2C2O4+2FeC2O4+2CO2↑+6H2O。下列说法错误的是
3K2C2O4+2FeC2O4+2CO2↑+6H2O。下列说法错误的是| A.Fe3+的最高能层电子排布式为3d5 |
| B.K3[Fe(C2O4)3]中铁离子的配位数为6 |
C.C2O 中C原子的杂化方式为sp3 中C原子的杂化方式为sp3 |
| D.K、Fe、C、H、O的电负性:K<Fe<H<C<O |
您最近一年使用:0次
4 . 第IVA族的元素在生产生活中有广泛应用。回答下列问题:
(1)CH3COOH的结构如图1所示,H、C、O电负性由大到小的顺序是___________ ,CH3COOH分子中键角1___________ 2(填“大于”“小于”或“等于”);CF3COOH酸性强于CH3COOH的原因是_______ 。

(2)硅的价电子轨道表示式___________ 。图2为SiO2结构,氧原子周围距离最近的氧原子有___________ 个。
(3)Pb的晶胞如图3所示。若晶胞参数为anm,则晶胞密度___________ g·cm-3。

(1)CH3COOH的结构如图1所示,H、C、O电负性由大到小的顺序是

(2)硅的价电子轨道表示式
(3)Pb的晶胞如图3所示。若晶胞参数为anm,则晶胞密度

您最近一年使用:0次
5 . 铜是生产、生活中常用的金属,工业上常利用黄铜矿(有效成分为CuFeS2)冶炼铜。回答下列问题:
(1)Fe在周期表中的位置为_______ ,基态S原子核外能量不同的电子有_______ 种。
(2)O、S、Se的电负性依次为3.5、2.5、2.4,产生这种差异的主要原因是_______ (已知O、S、Se的原子半径依次为73pm、102pm、116pm)。
(3)Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+,其中Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。已知部分微粒键角数据如下表所示:
用“→”标注配位键,[Cu(NH3)n]+的结构可表示为____ ,其∠HNH接近109.5°的原因是_____ 。
(4)铜与铝可形成多种组成不同的合金,其中一种合金的晶胞如图1所示(已知c= a),按图1中阴影面进行投影得到图2。
a),按图1中阴影面进行投影得到图2。

①已知晶胞中A点原子的分数坐标为( ,0,
,0, ),则B点原子的分数坐标为
),则B点原子的分数坐标为_______ 。
②该晶体的化学式为________ ;已知该晶体密度为dg·cm-3,则阿伏加德罗常数NA可表示为_______ mol-1(列出计算式即可)。
(1)Fe在周期表中的位置为
(2)O、S、Se的电负性依次为3.5、2.5、2.4,产生这种差异的主要原因是
(3)Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+,其中Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。已知部分微粒键角数据如下表所示:
| 微粒 | CH4 | NH3 | H2O | [Cu(NH3)n]+ |
| 键角 | ∠HCH=109.5° | ∠HNH=107.3° | ∠HOH=104.5° | HNH接近109.5° |
用“→”标注配位键,[Cu(NH3)n]+的结构可表示为
(4)铜与铝可形成多种组成不同的合金,其中一种合金的晶胞如图1所示(已知c=
 a),按图1中阴影面进行投影得到图2。
a),按图1中阴影面进行投影得到图2。
①已知晶胞中A点原子的分数坐标为(
 ,0,
,0, ),则B点原子的分数坐标为
),则B点原子的分数坐标为②该晶体的化学式为
您最近一年使用:0次
名校
解题方法
6 . 邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,结构简式如图所示。下列说法正确的是
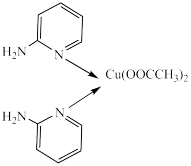

| A.Cu2+的配位数是2 |
| B.配位原子为N原子和O原子 |
| C.N原子的杂化类型均为sp3 |
| D.O的电负性与第一电离能均大于N |
您最近一年使用:0次
2022-05-11更新
|
145次组卷
|
2卷引用:山东省青岛地区2021-2022学年高二下学期期中考试化学试题
解题方法
7 . 2021年9月24日《科学》杂志发表了我国科学家的原创性重大突破,首次在实验室实现从CO2到淀粉的全合成。其合成路线如下:
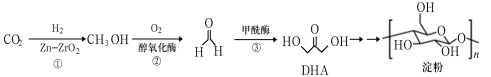
下列说法错误的是

下列说法错误的是
| A.电负性:O > C > H >Zn |
| B.CO2、HCHO、CH3OH分子中碳原子杂化方式分别是sp、sp2、sp3 |
| C.DHA分子间存在氢键 |
| D.甲醇分子中H-C-O键角大于甲醛分子中H-C-O键角 |
您最近一年使用:0次
名校
8 . 我国科学家成功利用 人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如下所示。下列说法错误的是
人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如下所示。下列说法错误的是

 人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如下所示。下列说法错误的是
人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如下所示。下列说法错误的是
| A.电负性:O>C>Zn>H |
B.甲醇分子中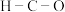 键角大于甲醛分子中 键角大于甲醛分子中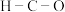 键角 键角 |
| C.DHA分子易溶于水 |
| D.该过程有利于实现“碳达峰、碳中和” |
您最近一年使用:0次
2022-05-10更新
|
123次组卷
|
2卷引用:山东省济宁市曲阜市第一中学2021-2022学年高二下学期期中测试化学试题
9 . 屠呦呦因在抗疟药青蒿素研究中的杰出贡献,成为我国首获科学类诺贝尔奖的人。青蒿素的结构简式如图所示,下列说法正确的是
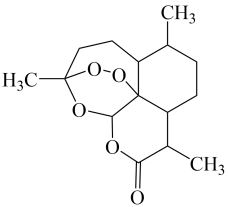

A.青蒿素的分子式为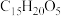 |
| B.组成元素的电负性由大到小顺序为:O>C>H |
| C.分子中所有碳原子的杂化方式相同 |
| D.分子中含有7个手性碳原子 |
您最近一年使用:0次
名校
解题方法
10 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
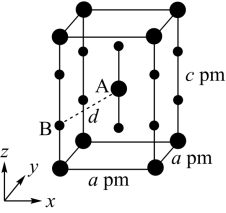
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题



