解题方法
1 . 材料是人类文明进步的阶梯,主族非金属元素是组成特殊材料的重要元素。请回答下列问题:
(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是_____ ,第一电离能从大到小的顺序是_____ 。
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是______ (填化学式);已知等电子体具有相同的空间构型,结合价电子对互斥理论可知N2O分子为______ 形。
(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是_____ (填符号);配合物T与[M(NH3)5(H2O)]Cl3组成所含微粒种类和数目相同,中心离子的配位数相同且T中也只有两种配体,若1molT溶于水,加入足量AgNO3溶液只生成2molAgCl,则T的配合物可表示为_____ 。
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为_____ 。

(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO
 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为

您最近一年使用:0次
2 . 亚硫酰氯(SOCl2)在农药、医药、染料等生产中有重要应用,是一种无色或淡黄色液体,易挥发,遇水极易反应生成两种酸性气体。回答下列问题:
(1)根据价电子对互斥理论,亚硫酰氯空间构型为_______ ,其构成元素电负性由大到小的顺序为_______ 。
(2)实验室可通过将二氧化硫和氯气通入一氯化硫(S2Cl2)中反应制取亚硫酰氯。
①一氯化硫的电子式为_______ ;
②该反应中还原剂与氧化剂的物质的量之比为_______ ;
③向Ba(OH)2溶液中滴加少量亚硫酰氯,有白色沉淀生成,发生反应的离子方程式为_______ 。
(3)MgCl2·6H2O、AlCl3·6H2O、FeCl2·4H2O等结晶水合氯化物在空气中受热脱水易发生水解反应,常用亚硫酰氯作脱水剂以制取无水氯化物。
①在加热条件下,亚硫酰氯与MgCl2·6H2O反应的化学方程式为_______ 。
②MgCl2·6H2O在空气中受热脱水过程中,热重分析测得剩余固体质量占初始固体质量的百分含量随温度变化的曲线如图所示。
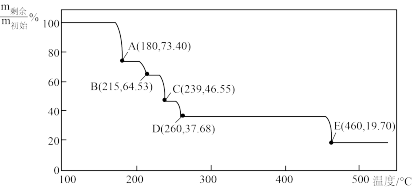
试判断A点固体的化学式为_______ ;460℃时发生反应的化学方程式为_______ 。
(1)根据价电子对互斥理论,亚硫酰氯空间构型为
(2)实验室可通过将二氧化硫和氯气通入一氯化硫(S2Cl2)中反应制取亚硫酰氯。
①一氯化硫的电子式为
②该反应中还原剂与氧化剂的物质的量之比为
③向Ba(OH)2溶液中滴加少量亚硫酰氯,有白色沉淀生成,发生反应的离子方程式为
(3)MgCl2·6H2O、AlCl3·6H2O、FeCl2·4H2O等结晶水合氯化物在空气中受热脱水易发生水解反应,常用亚硫酰氯作脱水剂以制取无水氯化物。
①在加热条件下,亚硫酰氯与MgCl2·6H2O反应的化学方程式为
②MgCl2·6H2O在空气中受热脱水过程中,热重分析测得剩余固体质量占初始固体质量的百分含量随温度变化的曲线如图所示。

试判断A点固体的化学式为
您最近一年使用:0次
2022-11-11更新
|
276次组卷
|
2卷引用:山东省青岛市四区县2022-2023学年高三上学期期中考试化学试题
解题方法
3 . 二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______ ,基态 中的核外电子有
中的核外电子有_______ 个空间运动状态。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和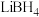 反应制得。
反应制得。
①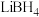 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是_______ ,B原子的杂化轨道类型是_______ , 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为_______ 。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______ 填元素符号。
(1)基态钛原子的价电子排布式为
 中的核外电子有
中的核外电子有(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和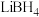 反应制得。
反应制得。①
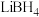 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是
| 元素 | M |
| 电离能(kJ/mol) | 738 |
| 1451 | |
| 7733 | |
| 10540 | |
| 13630 |
您最近一年使用:0次



