名校
解题方法
1 . 2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子二次电池正极铝钴膜主要含有 、Al等,处理该废料的一种工艺如图所示,下列说法正确的是
、Al等,处理该废料的一种工艺如图所示,下列说法正确的是
 、Al等,处理该废料的一种工艺如图所示,下列说法正确的是
、Al等,处理该废料的一种工艺如图所示,下列说法正确的是
A.酸溶时 做氧化剂,且温度不宜过高 做氧化剂,且温度不宜过高 |
| B.加氨水调pH的目的是除铝 |
C.沉钴的离子方程式为: |
| D.该流程中涉及的反应都是氧化还原反应 |
您最近一年使用:0次
名校
2 . 工业生产中除去电石渣浆(含CaO)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
A.碱性条件下,氧化性: |
B.过程Ⅱ中,反应的离子方程式为 |
C.将1mol 转化为 转化为 理论上消耗 理论上消耗 的体积为44.8L 的体积为44.8L |
| D.该过程中涉及的化学反应均是氧化还原反应 |
您最近一年使用:0次
名校
3 . 能量、速率与限度是认识和研究化学反应的重要视角,回答下列问题:
(1)天然气已成为我国主要的清洁能源,主要成分甲烷( )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:___________ (填字母)
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下,1mol甲烷完全燃烧时放出802kJ的热量
D.该反应中断键吸收的总能量低于形成键放出的总能量
②已知断开部分化学键需要的能量为,C―H:a kJ/mol,O=O:b kJ/mol,C=O:c kJ/mol,则形成1mol O―H释放的能量为___________ kJ。
(2)一定温度下在容积可变的密闭容器中投入10mol 和6mol
和6mol ,发生反应:
,发生反应:
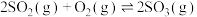
 。下列情况能说明该反应达到化学平衡的是
。下列情况能说明该反应达到化学平衡的是___________ 。
A.体系的压强保持不变
B.混合气体的密度保持不变
C.单位时间内生成1mol 的同时断开0.5mol O=O键
的同时断开0.5mol O=O键
D.混合气体的平均相对分子质量保持不变
E. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
(3)在一定条件下,二氧化硫和氧气反应过程中各物质物质的量浓度变化如图所示,根据图中判断,___________ ;20min时改变的反应条件可能是___________ 。
a加入催化剂 b.缩小容器容积 c.升高温度 d.增加 的物质的量
的物质的量
②第12min时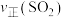
___________ 第18min时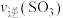 填(“>”“<”“=”或“无法比较”)。
填(“>”“<”“=”或“无法比较”)。
(1)天然气已成为我国主要的清洁能源,主要成分甲烷(
 )燃烧时的能量变化如图所示:
)燃烧时的能量变化如图所示:
A.甲烷完全燃烧时化学能全部转化为热能
B.由图可知二氧化碳比甲烷稳定
C.标准状况下,1mol甲烷完全燃烧时放出802kJ的热量
D.该反应中断键吸收的总能量低于形成键放出的总能量
②已知断开部分化学键需要的能量为,C―H:a kJ/mol,O=O:b kJ/mol,C=O:c kJ/mol,则形成1mol O―H释放的能量为
(2)一定温度下在容积可变的密闭容器中投入10mol
 和6mol
和6mol ,发生反应:
,发生反应: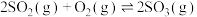
 。下列情况能说明该反应达到化学平衡的是
。下列情况能说明该反应达到化学平衡的是A.体系的压强保持不变
B.混合气体的密度保持不变
C.单位时间内生成1mol
 的同时断开0.5mol O=O键
的同时断开0.5mol O=O键D.混合气体的平均相对分子质量保持不变
E.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变(3)在一定条件下,二氧化硫和氧气反应过程中各物质物质的量浓度变化如图所示,根据图中判断,

a加入催化剂 b.缩小容器容积 c.升高温度 d.增加
 的物质的量
的物质的量②第12min时
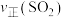
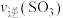 填(“>”“<”“=”或“无法比较”)。
填(“>”“<”“=”或“无法比较”)。
您最近一年使用:0次
名校
解题方法
4 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程如下:
Ⅰ.打开弹簧夹K2和K3,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹K3。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
Ⅰ.打开弹簧夹K2和K3,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹K3。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
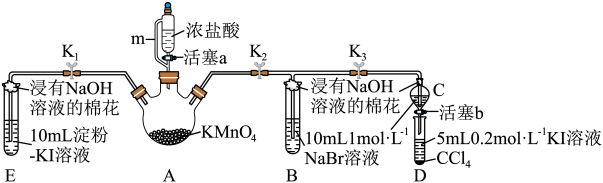
| A.装置A中m的作用是平衡压强,保证液体顺利流下 |
| B.装置中NaOH溶液的作用是吸收尾气,防止污染空气 |
| C.装置B和C中溶液变黄说明氧化性Cl2>Br2 |
| D.装置A中的KMnO4也可以换成MnO2 |
您最近一年使用:0次
名校
解题方法
5 . 常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活。
Ⅰ.用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
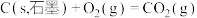


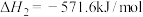

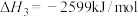
(1)请写出由 和
和 生成
生成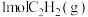 的热化学方程式:
的热化学方程式:__________ 。
Ⅱ.化学能转化为热能的转化率约30%,可见燃料直接燃烧会浪费大量能量。而燃料电池中化学能转化为电能的转化率接近100%。北京冬奥会使用氢氧燃料电池汽车,同时也实现了低碳环保。某种氢氧燃料电池的内部结构示意图如下图。__________ 。
(3)若电路中通过3mol电子,则负极消耗物质的质量为__________ 。
Ⅲ.锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”理念;锰酸锂可充电电池的总反应为:
 向
向__________ 移动(填“正极”或“负极”);
②充电时,电池的阳极反应式为__________ ,若此时转移 ,则石墨电极将增重
,则石墨电极将增重__________ g。
Ⅰ.用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
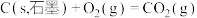


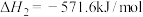

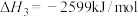
(1)请写出由
 和
和 生成
生成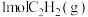 的热化学方程式:
的热化学方程式:Ⅱ.化学能转化为热能的转化率约30%,可见燃料直接燃烧会浪费大量能量。而燃料电池中化学能转化为电能的转化率接近100%。北京冬奥会使用氢氧燃料电池汽车,同时也实现了低碳环保。某种氢氧燃料电池的内部结构示意图如下图。

(3)若电路中通过3mol电子,则负极消耗物质的质量为
Ⅲ.锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”理念;锰酸锂可充电电池的总反应为:

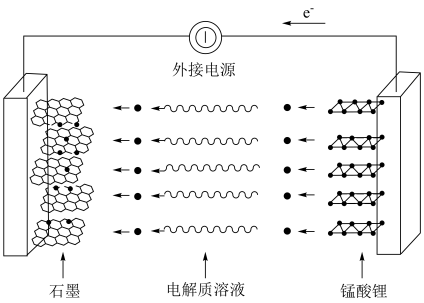
 向
向②充电时,电池的阳极反应式为
 ,则石墨电极将增重
,则石墨电极将增重
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.A、B、C、D、E为短周期主族元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物 和
和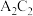 ,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
(1)B元素在元素周期表中的位置为__________ ;由A、C、D三种元素组成的化合物中含有的化学键为__________ 。
(2)写出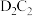 的电子式:
的电子式:__________ 。
(3)元素E的单质与元素D的最高价氧化物对应的水化物反应的离子方程式:__________ 。
(4)常温下, 与元素D的单质反应后,所得溶液的pH
与元素D的单质反应后,所得溶液的pH__________ (填“<”“=”或“>”)7。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,灼烧该化合物时,火焰呈__________ 色,DA能与水反应放出氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是__________ L。
Ⅱ.甲同学设计了图1装置探究硫和氯的非金属性相对强弱。__________ 。B装置的作用是除去 中的HCl,则B中的试剂是
中的HCl,则B中的试剂是__________ (填名称)。
(7)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:__________ 。
Ⅲ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(8)下列关于Rb的说法中不正确的是__________ 。
a.与水反应比钠更剧烈 b. 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳
c. 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH强
 和
和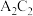 ,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
,E元素的周期数与主族序数相等。请用化学用语回答下列问题:(1)B元素在元素周期表中的位置为
(2)写出
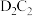 的电子式:
的电子式:(3)元素E的单质与元素D的最高价氧化物对应的水化物反应的离子方程式:
(4)常温下,
 与元素D的单质反应后,所得溶液的pH
与元素D的单质反应后,所得溶液的pH(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,灼烧该化合物时,火焰呈
Ⅱ.甲同学设计了图1装置探究硫和氯的非金属性相对强弱。

 中的HCl,则B中的试剂是
中的HCl,则B中的试剂是(7)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:
Ⅲ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(8)下列关于Rb的说法中不正确的是
a.与水反应比钠更剧烈 b.
 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳c.
 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性e.RbOH的碱性比同浓度的NaOH强
您最近一年使用:0次
名校
7 . 在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。___________ 。平衡时H2的转化率为___________ 。
(2)下列措施能增大反应速率的是___________ (填字母)。
(3)下列描述中能说明上述反应达到平衡状态的是___________。
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收___________ kJ 的能量。
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。

(2)下列措施能增大反应速率的是___________ (填字母)。
| A.升高温度 | B.降低压强 | C.减小 CH3OH 的浓度 | D.加入合适的催化剂 |
(3)下列描述中能说明上述反应达到平衡状态的是___________。
| A.CO、H2和CH3OH 三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗 2molH2 的同时生成 1molCH3OH |
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收
您最近一年使用:0次
名校
8 . 将 9.2g 铜和铁的混合物放入一定体积的稀硝酸溶液中,充分反应后得到标准状况下1.12LNO ,有金属剩余;向所得溶液中继续加入足量的稀硫酸,金属完全溶解且又得到标准状况下1.12LNO 。若向反应后的溶液中加入 KSCN 溶液,溶液不变红,则下列说法中正确的是
| A.原混合物中铜和铁各 0.1mol |
| B.第一次剩余金属全部为铜 |
| C.反应后的溶液中溶质为硝酸亚铁和硝酸铜 |
| D.若向反应后的溶液中再加入足量稀硝酸,又可得到约标准状况下 0.37LNO |
您最近一年使用:0次
9 . “探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是
| 选项 | 实验目的 | 操作或现象 |
| A | 制作简单原电池 | 将铁钉和铜丝用导线连接并插入FeCl3 溶液中即可形成原电池 |
| B | 验证碳能与浓硝酸反应 | 向浓硝酸中插入红热的碳,产生红棕色气体 |
| C | 鉴别溴蒸气和NO2 | 分别通入AgNO3 溶液中,产生浅黄色沉淀的是溴蒸气 |
| D | 向某溶液中加入足量稀硝酸,无明显现象,再加入 Ba(NO3)2 溶液,出现白色沉淀 | 溶液中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 某同学用下列装置完成了浓硫酸和 SO2 性质实验(夹持装置已省略)。下列说法正确的是
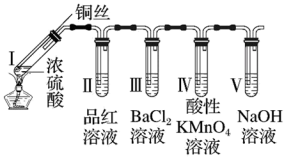
| A.反应后,向试管Ⅰ中加入蒸馏水,溶液呈蓝色 |
| B.试管Ⅴ中的NaOH溶液可用 NaHSO3溶液代替 |
| C.试管Ⅳ中 KMnO4溶液褪色,说明SO2具有氧化性 |
| D.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4 |
您最近一年使用:0次



