名校
解题方法
1 . 工业合成氮是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,已知反应为
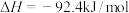 ,
,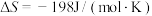 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
1.已知: 下合成氨反应的平衡常数
下合成氨反应的平衡常数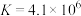 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。
2.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是 。
3. 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为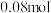 、
、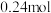 、
、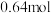 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行_______ 。
4.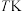 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为_______ (答案保留2位有效数字);其他条件不变,若向此平衡体系中再充入 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数_______ 40%(填“<”“>”或“=”)
5.合成氨反应的正反应活化能_______ 逆反应活化能(填“大于”、“小于”或“等于”),加入催化剂比不加催化剂时,正反应活化能_______ (填“增高”或“降低”或“不变”),逆反应活化能_______ (填“增高”或“降低”或“不变”),催化剂改变了反应历程,同等程度提高了正、逆反应的速率。

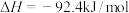 ,
,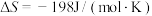 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:1.已知:
 下合成氨反应的平衡常数
下合成氨反应的平衡常数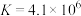 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。| A.在该温度下反应速率较快 |
| B.在该温度下正反应进行得比较完全 |
| C.在该温度下加入催化剂,平衡常数将发生变化 |
| D.仅从K值可得知该反应的平衡转化率 |
| A.K值变化,平衡不一定移动 | B.K值不变,平衡可能移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为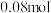 、
、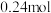 、
、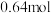 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行4.
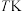 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数5.合成氨反应的正反应活化能
您最近一年使用:0次
名校
解题方法
2 . 工业合成氮是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,已知反应为
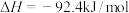 ,
,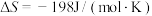 ,该反应的焓变和熵变随温度变化很小,可视为常数。
,该反应的焓变和熵变随温度变化很小,可视为常数。
查阅文献资料,化学键的键能如下表:
1.合成氨反应中若断裂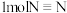 键则生成
键则生成_______ 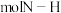 键,试推测N-H键的键能为
键,试推测N-H键的键能为_______  (保留到小数点后一位)
(保留到小数点后一位)
又已知: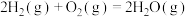
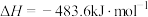 ,
,
2.氨气完全燃烧生成 和
和 的热化学方程式为:
的热化学方程式为:_______ 。
3.请通过计算判断常温(25℃)下,合成氨反应是否能够自发进行_______ ,室温下推动该反应自发进行的主要因素是_______ (填“焓变”或“熵变”)
4.在一定恒容密闭容器中,将一定量的氢气和氮气通入发生合成氨反应,下列情况可说明反应已经达到化学平衡状态的是 。
5.合成氨的平衡常数表达式
_______ 。若温度升高,K值将_______ (填写“升高”、“降低”或“不变”)

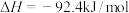 ,
,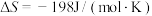 ,该反应的焓变和熵变随温度变化很小,可视为常数。
,该反应的焓变和熵变随温度变化很小,可视为常数。查阅文献资料,化学键的键能如下表:
化学键 |
|
|
| 436 | 946 |
1.合成氨反应中若断裂
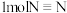 键则生成
键则生成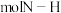 键,试推测N-H键的键能为
键,试推测N-H键的键能为 (保留到小数点后一位)
(保留到小数点后一位)又已知:
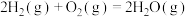
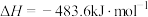 ,
,2.氨气完全燃烧生成
 和
和 的热化学方程式为:
的热化学方程式为:3.请通过计算判断常温(25℃)下,合成氨反应是否能够自发进行
4.在一定恒容密闭容器中,将一定量的氢气和氮气通入发生合成氨反应,下列情况可说明反应已经达到化学平衡状态的是 。
A.断裂 键的同时断裂 键的同时断裂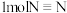 键 键 |
B.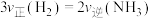 |
C. 、 、 和 和 的物质的量浓度之比为 的物质的量浓度之比为 |
| D.混合气体的平均摩尔质量不再改变 |

您最近一年使用:0次
3 . 下列说法错误的是
| A.需要加热的反应不一定是吸热反应 |
| B.燃料的燃烧是放热反应 |
C. 物质燃烧时所放出的热量叫做燃烧热 物质燃烧时所放出的热量叫做燃烧热 |
| D.燃料燃烧时空气并不是越多越好 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
| A.物质发生化学变化并不一定都伴随着能量变化 |
| B.只要有能量变化的都是化学变化 |
C.焓变是指 物质参加反应时的能量变化 物质参加反应时的能量变化 |
| D.使用催化剂不能改变反应焓变 |
您最近一年使用:0次
5 . 下图是医用胶504的一条合成路线(部分反应试剂和反应条件未标出)。
(i)烃A的质谱图中分子离子峰的m/z值为28。___________ 。
(2)B中所含的官能团是___________ (写名称);E→F的反应条件是___________ ;F→G的反应类型是___________ 。
(3)写出G→H的化学方程式___________ 。
(4)利用题示信息,以CH3CHO为原料,设计制备正丁醇的合成线路(无机试剂任选)___________ 。

(i)烃A的质谱图中分子离子峰的m/z值为28。
(ii)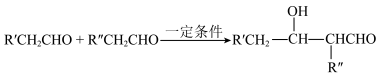
(2)B中所含的官能团是
(3)写出G→H的化学方程式
(4)利用题示信息,以CH3CHO为原料,设计制备正丁醇的合成线路(无机试剂任选)
您最近一年使用:0次
解题方法
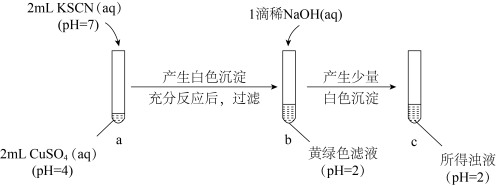
6 . 资料显示:由于CuI沉淀强烈吸附I2,故在接近滴定终点时必需加入适量的KSCN,释放出被吸附的I2。
已知:Cu2+可与SCN-反应生成 CuSCN(白色沉淀)和(SCN)2;(SCN)2的性质与Cl2相似,在水溶液中呈黄色,可与水、碱等发生反应。常温下,某同学对Cu2+与SCN-的反应进行探究:___________ ;分析往b中加入1滴浓NaOH溶液后,产生少量白色沉淀的化学原理___________ 。
已知:Cu2+可与SCN-反应生成 CuSCN(白色沉淀)和(SCN)2;(SCN)2的性质与Cl2相似,在水溶液中呈黄色,可与水、碱等发生反应。常温下,某同学对Cu2+与SCN-的反应进行探究:
您最近一年使用:0次
解题方法
7 . 流化床膜反应器在制氢领域颇具潜力。如图为利用该反应器进行CH4-H2O催化重整的示意图。(反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)
CO2(g)+4H2(g)  H=164.6 kJ·mol-1)
H=164.6 kJ·mol-1)___________ (选填“高温”、“低温”或“任意温度”)条件下能自发进行。该工艺中原料气无需预热,分析需持续通入少量空气的目的可能是___________ ;图中流化床膜的作用是___________ 。
 CO2(g)+4H2(g)
CO2(g)+4H2(g)  H=164.6 kJ·mol-1)
H=164.6 kJ·mol-1)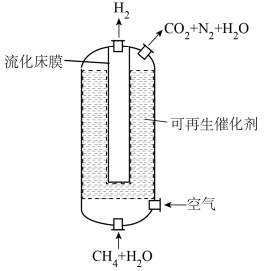
您最近一年使用:0次
解题方法
8 . 除杂过滤得到的SiO2可用于制作光导纤维。SiO2晶胞(图1),它可以看作是在单晶Si晶胞(图2)的基础上,于每两个Si原子之间“插入”1个O原子。___________ 个;若SiO2晶体密度为 ρ g·cm-3,则该晶胞体积为___________ cm3(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。

您最近一年使用:0次
解题方法
9 . O3分子内部存在“三中心四电子”的离域π键(如图虚线部分所示),由于O3分子的中心氧原子较端位氧原子多提供一个电子,故中心氧原子带部分正电荷,端位氧原子带部分负电荷。___________ (选填“是”或“否”),解释O3在水中溶解度大于O2的可能原因。___________
2.判断并解释反应2O3=3O2是否属于氧化还原反应___________ 。
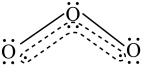
2.判断并解释反应2O3=3O2是否属于氧化还原反应
您最近一年使用:0次
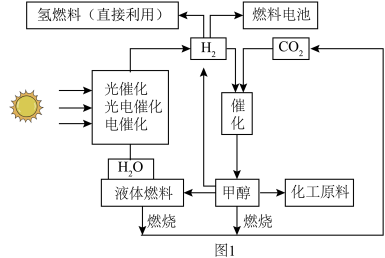
10 . “液态阳光”是指利用太阳能等可再生能源产生的电力电解水生产“绿色”氢能,再和从空气中捕获的二氧化碳通过催化过程转化为甲醇等液体燃料。甲醇可以直接作为能源,也可以作为化工原料。图1是“液态阳光”的合成技术线路示意图。___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
(3)CH3OH的下列性质与氢键无关的是___________。
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
(5)下列关于CO2的说法错误的是___________。
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。___________ 。
A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式___________ 。
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g) CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=___________ 。
A.石油 B.煤 C.风能
(2)与CH3OH互为同系物的是___________。
A.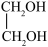 | B.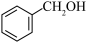 | C. | D.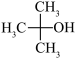 |
(3)CH3OH的下列性质与氢键无关的是___________。
| A.极易溶于水 | B.沸点比CH3SH高 | C.易燃烧 | D.具有还原性 |
(4)利用晶体X射线衍射技术不能测定CH3OH晶体的___________。
| A.化学键的键长 | B.化学键的键能 |
| C.化学键的键角 | D.分子在晶胞中的实际排列情况 |
(5)下列关于CO2的说法错误的是___________。
| A.所有原子共平面 | B.碳原子采取sp2杂化 |
| C.碳原子有2对价层电子对 | D.干冰易升华,可用作人工降雨 |
(6)太阳能转化为电能时,要用到Si、GaP、GaAs等半导体材料,Ga元素与As同周期,与Al同主族。下列说法正确的是___________。
| A.第一电离能:I1(Si)<I1(P) | B.原子半径:r(As)>r(Ga) |
| C.热稳定性:AsH3>PH3 | D.酸性:H2SiO3>H3PO4 |
(7)某同学用图2所示装置(省略夹持装置)自制简单的氢氧燃料电池。

A.石墨棒B为阳极 B.此过程中化学能转化为电能
C.石墨棒A的电极反应:2H++2e−=H2↑ D.石墨棒A和B产生等体积的气体
②通电一段时间后,断开K1,闭合K2,发光二极管立即发光。写出正极的电极反应式
(8)已知H2(g)和CH3OH(l)的燃烧热分别为﹣286kJ·mol−1和﹣727kJ·mol−1.CO2和H2通过下列反应制备甲醇:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l),该反应的ΔH=
CH3OH(l)+H2O(l),该反应的ΔH=
您最近一年使用:0次

 键
键 键
键