解题方法
1 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 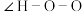 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: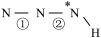 ,
, 为
为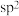 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为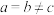 ,
,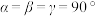 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
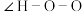 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: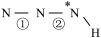 ,
, 为
为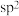 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为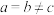 ,
,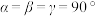 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解题方法
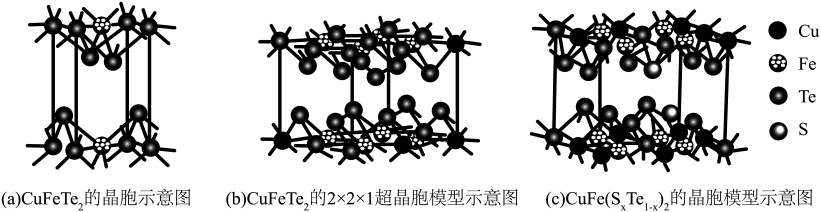
2 . 四方晶系CuFeTe2晶体是一种p型半导体,在太阳能半导体薄膜中具有巨大的潜在应用价值,其晶胞示意图如图a、图b所示。
(1)基态Cu原子的价电子排布式为___________ ;
(2)H2S中S的杂化方式为___________ ;H2O、H2Te、H2S沸点依次降低的原因是___________ 。
(3)CuFeTe2中元素的电负性由大到小的顺序为___________ ;Te的配位数为___________ 。
(4)向CuFeTe2中掺杂S原子会改善半导体性能。由图(c)可知x=___________ ;掺杂后晶胞参数分别为apm,apm,cpm,设NA为阿伏加德罗常数的值。晶体CuFe(SxTe1-x)的密度为___________ g/cm3(用含a、c和NA的代数式表示)。
(1)基态Cu原子的价电子排布式为
(2)H2S中S的杂化方式为
(3)CuFeTe2中元素的电负性由大到小的顺序为
(4)向CuFeTe2中掺杂S原子会改善半导体性能。由图(c)可知x=
您最近半年使用:0次
名校
解题方法
3 . Zn、Fe、Cu、Cr等过渡金属的原子或离子易通过配位键形成配合物或配离子。回答下列问题:
I.一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由小到大的顺序为_______ , 中键角F-B-F
中键角F-B-F_______ M中键角F-B-F(填“>”、“<”或“=”)。
(2)As与N为同一主族元素,有机酸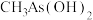 的沸点比
的沸点比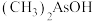 高的原因是
高的原因是_______ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
Ⅱ. 的结构如下图所示。
的结构如下图所示。
(4)与Fe最外层电子数相同且同周期的元素有_______ 种。
(5)图示 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是_______ (填序号)。
Ⅲ.一种立方钙钛矿型晶体 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
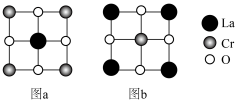
(6)图a的晶胞参数为xpm,则O与O的最小核间距为_______ pm;图b晶胞中O的位置为_______ (填“体心”“顶点”“面心”“棱心”)。
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为_______ 。
I.一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
(1)H、C、N、F四种元素电负性由小到大的顺序为
 中键角F-B-F
中键角F-B-F(2)As与N为同一主族元素,有机酸
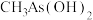 的沸点比
的沸点比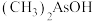 高的原因是
高的原因是(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
A. | B. |
C. | D. |
Ⅱ.
 的结构如下图所示。
的结构如下图所示。
(4)与Fe最外层电子数相同且同周期的元素有
(5)图示
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是Ⅲ.一种立方钙钛矿型晶体
 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
(6)图a的晶胞参数为xpm,则O与O的最小核间距为
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
您最近半年使用:0次
4 . B、C、N、O、F是重要的非金属元素,在日常生活和化工生产中有广泛的应用。回答下列问题:
(1)C、N、O的第三电离能由大到小的顺序是_______ ,电负性由大到小的顺序是_______ 。
(2)三氟化硼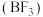 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是_______ 。
(3)已知: 中存在大π键:
中存在大π键: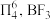 中
中 键的键能是
键的键能是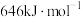 ,而
,而 中
中 键的键能仅
键的键能仅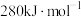 。
。 的分子构型是
的分子构型是_______ ; 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是_______ 。
(4)亚肼 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和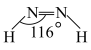 。试推测在水中的溶解度:
。试推测在水中的溶解度:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
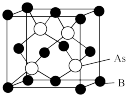
(5)超高热导率半导体材料一砷化硼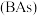 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为_______  (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
(1)C、N、O的第三电离能由大到小的顺序是
(2)三氟化硼
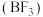 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是(3)已知:
 中存在大π键:
中存在大π键: 中
中 键的键能是
键的键能是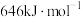 ,而
,而 中
中 键的键能仅
键的键能仅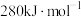 。
。 的分子构型是
的分子构型是 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是(4)亚肼
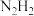 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和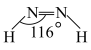 。试推测在水中的溶解度:
。试推测在水中的溶解度:
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(5)超高热导率半导体材料一砷化硼
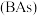 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为 (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
您最近半年使用:0次
名校
5 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的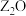 和黑色的
和黑色的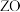 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。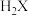 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)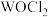 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向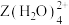 的溶液通入
的溶液通入 ,会生成
,会生成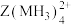 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的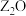 和黑色的
和黑色的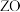 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是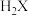 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
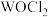 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
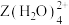 的溶液通入
的溶液通入 ,会生成
,会生成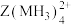 的原因是
的原因是
您最近半年使用:0次
名校
6 . 过渡元素镍(Ni)、铬(Cr)都是重要的合金元素,他们的配合物在科技生活中都有很重要的应用,例如我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:

回答下列问题:
(1)Cr3+价电子核外电子排布式为______ ,分子甲中除铬外其他元素的电负性由大到小依次为______ (填元素符号)。
(2)一定条件下环戊二烯 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为_____ , 中大π键可表示为
中大π键可表示为_____ 。
(3)化合物丙中1、2、3、4处的化学键是配位键的是_______ 。
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是__________ 。
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为_________ 。
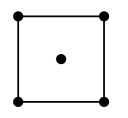
(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是_________ (用字母a、b、c表示),晶胞中镍的分数坐标有____ 种。


回答下列问题:
(1)Cr3+价电子核外电子排布式为
(2)一定条件下环戊二烯
 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为 中大π键可表示为
中大π键可表示为(3)化合物丙中1、2、3、4处的化学键是配位键的是
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为

(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是

您最近半年使用:0次
名校
7 . Ⅰ.魔酸(Magic acid)是最早发现的超强酸,由五氟化锑(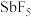 )和氟磺酸(
)和氟磺酸(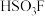 )按体积比
)按体积比 混合制成的混酸,酸性为纯硫酸的1000万倍。
混合制成的混酸,酸性为纯硫酸的1000万倍。
(1)氟磺酸(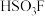 )中元素电负性由大到小的顺序为
)中元素电负性由大到小的顺序为___________ (写汉字名称)。
(2)魔酸根离子中与中心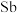 原子配位的氟磺酸中的原子为
原子配位的氟磺酸中的原子为___________ (填元素符号)。
(3)五氟化锑(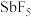 )分子中
)分子中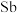 的杂化类型是下列中的
的杂化类型是下列中的___________ (填字母序号)。
a. b.
b.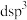 c.
c.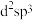 d.
d.
Ⅱ.使用超酸可以活化碳氢化合物,如六氟合锑酸( 和
和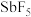 的物质的量比
的物质的量比 混合,酸性估计可达无水硫酸的
混合,酸性估计可达无水硫酸的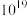 倍)溶液中对甲基环戊烷的羰基化反应。对
倍)溶液中对甲基环戊烷的羰基化反应。对 键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的
键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的 捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“
捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“ ”表示)。
”表示)。
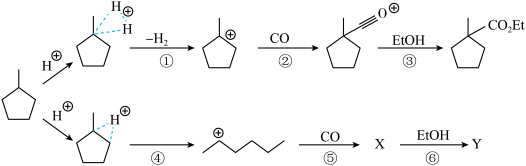
(4)“步骤①”生成的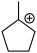 可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式
可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式___________ (除题给产物外任写1种)。
(5)步骤③的反应方程式为___________ 。
(6)满足下列条件的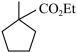 的同分异构体种类有
的同分异构体种类有___________ 种(不考虑立体异构)。
a.存在六元环状结构、且环上只有1~2个侧链
b.能发生银镜反应
c.热氢氧化钠溶液中能水解
(7)Y的系统名称为___________ 。
 )和氟磺酸(
)和氟磺酸(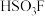 )按体积比
)按体积比 混合制成的混酸,酸性为纯硫酸的1000万倍。
混合制成的混酸,酸性为纯硫酸的1000万倍。(1)氟磺酸(
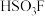 )中元素电负性由大到小的顺序为
)中元素电负性由大到小的顺序为(2)魔酸根离子中与中心
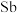 原子配位的氟磺酸中的原子为
原子配位的氟磺酸中的原子为(3)五氟化锑(
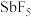 )分子中
)分子中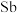 的杂化类型是下列中的
的杂化类型是下列中的a.
 b.
b.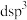 c.
c.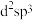 d.
d.
Ⅱ.使用超酸可以活化碳氢化合物,如六氟合锑酸(
 和
和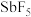 的物质的量比
的物质的量比 混合,酸性估计可达无水硫酸的
混合,酸性估计可达无水硫酸的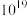 倍)溶液中对甲基环戊烷的羰基化反应。对
倍)溶液中对甲基环戊烷的羰基化反应。对 键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的
键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的 捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“
捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“ ”表示)。
”表示)。
(4)“步骤①”生成的
 可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式
可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式(5)步骤③的反应方程式为
(6)满足下列条件的
 的同分异构体种类有
的同分异构体种类有a.存在六元环状结构、且环上只有1~2个侧链
b.能发生银镜反应
c.热氢氧化钠溶液中能水解
(7)Y的系统名称为
您最近半年使用:0次
解题方法
8 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如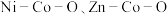 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如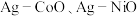 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如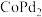 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物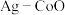 而非
而非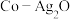 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩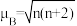 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩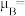
___________ 。
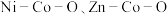 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如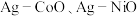 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如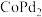 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物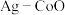 而非
而非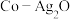 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
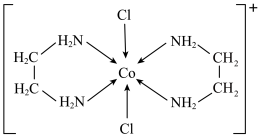
 的价电子轨道表示式是
的价电子轨道表示式是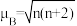 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩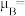
您最近半年使用:0次
真题
解题方法
9 . 三氯甲硅烷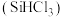 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为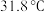 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
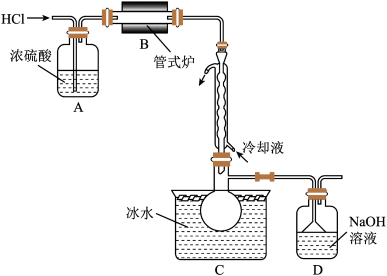
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____ ;判断制备反应结束的实验现象是_____ 。图示装置存在的两处缺陷是_____ 。
(2)已知电负性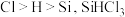 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_____ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
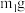 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____ ,②_____ (填操作名称),③称量等操作,测得所得固体氧化物质量为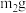 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为_____ (填标号)。测得样品纯度为_____ (用含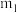 、
、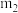 的代数式表示)。
的代数式表示)。

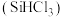 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为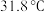 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性
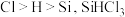 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。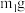 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①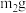 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为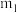 、
、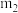 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2023-06-19更新
|
10388次组卷
|
16卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(实验综合题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 硅及其化合物(已下线)T26-工业流程题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届河北省实验中学高三年级上学期第一次月考化学试题
解题方法
10 . 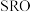 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成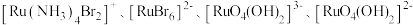 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中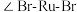 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

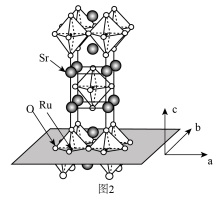
(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
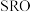 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成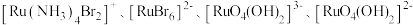 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中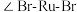 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次



